你可能感兴趣的试题
消耗硫酸亚铁的物质的量为n(2-x) 处理废水中的Cr2O72-的物质的量为nx/2 反应中发生转移的电子数为3nxmol 在FeO·FeyCrxO3中,3x=y
处理的废水中含Cr2O72- 的物质的量为 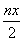 mol 反应中发生转移的电子数为3nx mol 在FeO·FeyCrxO3中3x=y 消耗硫酸亚铁铵的物质的量为n(2x+1)mol[
mol 反应中发生转移的电子数为3nx mol 在FeO·FeyCrxO3中3x=y 消耗硫酸亚铁铵的物质的量为n(2x+1)mol[
消耗硫酸亚铁铵的物质量为n(2-x)mol 处理废水中Cr2O72- 的物质的量为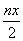 mol 反应中发生转移的电子数为3nx mol 在FeO·FeyCrxO3中3x=y
mol 反应中发生转移的电子数为3nx mol 在FeO·FeyCrxO3中3x=y
臭氧氧化法在工业废水处理领域只可用于降低BOD、COD 氯氧化法在工业废水处理领域重要的应用是脱色和去除氢化物 处理含铬废水时,还原反应pH值宜控制在7~9之间 处理含铬废水是利用还原剂将Cr3+转化为Cr6+
消耗硫酸亚铁铵的物质量为n(2-x)mol 处理废水中Cr2O72- 的物质的量为(nx)/2 mol 反应中发生转移的电子数为3nx mol 在FeO·FeyCrxO3中3x=y
FeSO4在反应中作氧化剂 随着反应的进行,该废水的pH会减小 若该反应转移0.6mol e﹣,则会有0.2mol Cr2O.72﹣ 被还原 除去废水中含铬元素离子的过程包括氧化还原反应和复分解反应
x=0.5,a=8 x=0.5,a=10 x=1.5,a=8 x=1.5,a=10
消耗硫酸亚铁铵的物质量为n(2-x)mol 处理废水中Cr2O72- 的物质量为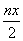 mol 反应中发生转移的电子数为3nx mol 在FeO·FeyCrxO3中3x=y
mol 反应中发生转移的电子数为3nx mol 在FeO·FeyCrxO3中3x=y
臭氧氧化法在工业废水处理领域只可用于降低BOD、COD 氯氧化法在工业废水处理领域重要的应用是脱色和去除氰化物 处理含铬废水时还原反应pH值宜控制在7~9之间 处理含铬废水时利用还原剂可将Cr3+转化为Cr6+
消耗硫酸亚铁的物质的量为n(2-x) 处理废水中的Cr2O72-的物质的量为nx/2 反应中发生转移的电子数为3nxmol 在FeO·FeyCrxO3中,3x=y
溶液颜色保持不变,说明上述可逆反应达到平衡状态 若用绿矾(FeSO4·7H2O)作还原剂,处理1L废水,至少需要917.4 g 常温下转化反应的平衡常数K=l×1014.则转化后所得溶液的pH=6 常温下Ksp[Cr(OH)3]=1×10-32,要使处理后废水中的c(Cr3+)降至1×10-5mol/L.,应调溶液的pH=5

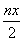 mol 反应中发生转移的电子数为3nx mol 在FeO·FeyCrxO3中3x=y 消耗硫酸亚铁铵的物质的量为n(2x+1)mol[
mol 反应中发生转移的电子数为3nx mol 在FeO·FeyCrxO3中3x=y 消耗硫酸亚铁铵的物质的量为n(2x+1)mol[
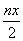 mol 反应中发生转移的电子数为3nx mol 在FeO·FeyCrxO3中3x=y
mol 反应中发生转移的电子数为3nx mol 在FeO·FeyCrxO3中3x=y
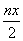 mol 反应中发生转移的电子数为3nx mol 在FeO·FeyCrxO3中3x=y
mol 反应中发生转移的电子数为3nx mol 在FeO·FeyCrxO3中3x=y