你可能感兴趣的试题
决定元素种类的是——电子数 决定元素化学性质的是——原子的核外电子数 决定元素相对原子质量的是——中子数 决定元素周期表中原子序数的是——核电荷数
元素④的原子序数小于元素⑦的原子序数 ②、③处于同一周期 上述八种元素最高价氧化物对应的水化物中,⑤号酸性最强 ⑧号元素原子结构示意图为: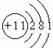
非金属元素组成的化合物中只含共价键 IA族金属元素是同周期中金属性最强的元素 同种元素的原子均有相同的质子数和中子数 VIIA族元素的阴离子性还原性越强,其最高价氧化物对应水化物的酸性越强
Na、Mg、Al原子最外层电子数依次增多 P.、S.、Cl元素最高正化合价依次增大 N.、O.、F.得电子能力依次减弱 LiOH、NaOH、KOH的碱性逐渐增强
非金属元素组成的化合物中只含共价键 ⅠA族金属元素是同周期中金属性质最强的元素 同种元素的原子均有相同的质子数和中子数 ⅦA族元素的阴离子还原性越强,其最高价氧化物对应水化物的酸性越强
非金属元素组成的化合物中只含共价键 原子半径:Na>O.;离子半径:Na+<O2- 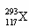 和
和 两种核素的核外电子数之差为1 ⅦA族元素的阴离子还原性越强,其最高价氧化物对应水化物的酸性越强
两种核素的核外电子数之差为1 ⅦA族元素的阴离子还原性越强,其最高价氧化物对应水化物的酸性越强
随原子序数的递增,元素原子的核外电子数逐渐增多,原子半径逐渐减小 若两种不同的核素具有相同的中子数,则二者一定不属于同种元素 若两种元素原子的最外层电子数相同,则元素最高正价一定相同 电子层结构相同的微粒,其化学性质一定相似
11种元素中形成的非金属单质都有非极性共价键 ②⑨处于同一周期,④⑧处于同一主族 11种元素中最高价氧化物对应的水化物,⑦号酸性最强 ⑥原子结构示意图为:
ⅠA.族元素的金属性一定比ⅡA.族的金属性强 族序数等于周期序数的元素一定是金属元素 全部由非金属元素组成的化合物中只含共价键 13C.和14C.互为同位素,化学性质相似
随着原子序数的递增,元素原子的核外电子数增多,原子半径逐渐减小 若两种不同核素具有相同的中子数,则二者一定不属于同种元素 若两种元素的原子的最外层电子数相同,则元素的最高正价一定相同 电子层结构相同的微粒,其化学性质一定相似
非金属元素组成的化合物中只含共价键 IA族金属元素是同周期中金属性最强的元素 同种元素的原子均有相同的质子数和中子数 VIIA族元素的阴离子性还原性越强,其最高价氧化物对应水化物的酸性越强
元素周期表中位于金属和非金属非界线附近的元素属于过渡元素 短周期元素中,元素符号用一个大写英文字母表示的元素共有7种 第三周期元素的最高正化合价等于它所处的主族序数 共价化合物中各原子都一定满足最外层8电子稳定结构
非金属元素组成的化合物中只含共价键 IA族金属元素是同周期中金属性最强的元素 同种元素的原子均有相同的质子数和中子数 ⅦA.族元素的阴离子还原性越强,其最高价氧化物对应水化物的酸性越强
Na、Mg、Al原子最外层电子数依次增多 P.、S.、Cl元素最高正化合价依次增大 Li、Na、K.的电子层数依次增多 N.、O.、F.得电子能力依次减弱
非金属元素组成的化合物中只含共价键 ⅠA族金属元素是同周期中金属性最强的元素 同种元素的原子均有相同的质子数和中子数 ⅦA族元素的阴离子还原性越强,其最高价氧化物对应水化物的酸性越强
原子核均是由质子和中子构成的 氧原子最外层有6个电子,其最低化合价为-2 卤族元素的阴离子还原性越强,则其最高价氧化物对应水化物的酸性越弱 非金属元素组成的化合物中可能含离子键
同种元素的原子可以有不同的中子数 同主族元素从上到下,单质的熔点逐渐降低 ⅦA.族元素的阴离子还原性越强,其最高价氧化物对应的水化物的酸性越强 非金属元素组成的化合物中只含共价键
非金属元素组成的化合物中只含共价键 ⅠA.族金属元素是同周期中金属性最强的元素 同种元素的原子均有相同的质子数和中子数 ⅦA.族元素的阴离子还原性越强,其最高价氧化物对应水化物的酸性越强
非金属元素组成的化合物中只含共价键 ⅠA.族金属元素是同周期中金属性最强的元素 同种元素的原子均有相同的质子数和中子数 ⅦA.族元素的阴离子还原性越强,其最高价氧化物对应的水化物的酸性越强
非金属元素组成的化合物中只含共价键 ⅠA.金属元素是同周期中金属性质最强的元素 种元素的原子均有相同的质子数和中子数 ⅦA.族元素的阴离子还原性越强,其最高阶氧化物对应水化物的酸性越强
ⅠA.金属元素是同周期中金属性质最强的元素 种元素的原子均有相同的质子数和中子数 ⅦA.族元素的阴离子还原性越强,其最高阶氧化物对应水化物的酸性越强

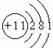
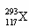 和
和 两种核素的核外电子数之差为1 ⅦA族元素的阴离子还原性越强,其最高价氧化物对应水化物的酸性越强
两种核素的核外电子数之差为1 ⅦA族元素的阴离子还原性越强,其最高价氧化物对应水化物的酸性越强

 ⅠA.金属元素是同周期中金属性质最强的元素 种元素的原子均有相同的质子数和中子数 ⅦA.族元素的阴离子还原性越强,其最高阶氧化物对应水化物的酸性越强
ⅠA.金属元素是同周期中金属性质最强的元素 种元素的原子均有相同的质子数和中子数 ⅦA.族元素的阴离子还原性越强,其最高阶氧化物对应水化物的酸性越强