你可能感兴趣的试题
已知2SO2(g)+O2 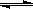 2SO3(g) 为放热反应,则SO2的能量一定高于SO3的能量 已知 (石墨,s)==C(金刚石,s) △H>0,则金刚石比石墨稳定 C.已知H+(aq)+OH-(aq)=H2O(1) △H=-57.3kJ/mol,则任何酸碱中和反应的热效应均为57.3 kJ 已知:2C(s) +2O2 (g) ==2 CO2(g) △H1 2C(s) +O2 (g) ==2 CO (g) △H2 则△H1<△H2
2SO3(g) 为放热反应,则SO2的能量一定高于SO3的能量 已知 (石墨,s)==C(金刚石,s) △H>0,则金刚石比石墨稳定 C.已知H+(aq)+OH-(aq)=H2O(1) △H=-57.3kJ/mol,则任何酸碱中和反应的热效应均为57.3 kJ 已知:2C(s) +2O2 (g) ==2 CO2(g) △H1 2C(s) +O2 (g) ==2 CO (g) △H2 则△H1<△H2
N2的能量一定高于NH3 H2的能量一定高于NH3 N2和H2的总能量一定高于NH3的总能量 因该反应为放热反应,故不必加热就可发生
该反应是一个放热反应 参加反应的氢气和氧气的总能量高于反应生成的水的总能量 该反应是一个吸热反应 参加反应的氢气和氧气的总能量低于反应生成的水的总能量
CH30H转变成H2的过程一定要吸收能量 ①反应中,反应物的总能量高于生成物的总能量 根据②推知反应:CH3OH(l)+1/202(g)=CO2(g)+2H2(g) △H>一192.9 kJ/mol 反应②的能量变化如图所示 
若CO的燃烧热为∆H.3,则H2的燃烧热为∆H.3-∆H.1 反应CH4(g)+CO2(g)═2CO(g)+2H2(g)的∆H.=∆H.2-∆H.1 若反应②的反应物总能量低于生成物总能量,则∆H.2<0 若等物质的量CO和H2完全燃烧生成气态产物时前者放热更多,则∆H.1>0
根据反应①,64gCH3OH完全燃烧放出的热量为98kJ
反应①中的能量变化如上图所示
CH3OH转变成H2的过程一定要吸收能量
根据②推知反应CH3OH(l)+1/2O2(g)=CO2(g)+2H2(g)的△H>-192.9kJ·mol-1
已知2SO2(g)+O2  2SO3(g)为放热反应,则SO2的能量一定高于SO3的能量 已知 (石墨,s)=C.(金刚石,s) △H.﹥0,则金刚石比石墨稳定 C.已知H+(aq)+OH–(aq)=H2O(1) △H.= -57.3kJ·mol-1,则任何酸碱中和的反应热均为57.3 kJ 已知:2C(s)+2O2(g)=2CO2(g) △H.1,2C(s)+O2(g)=2CO(g) △H.2;则△H.1﹤△H.2
2SO3(g)为放热反应,则SO2的能量一定高于SO3的能量 已知 (石墨,s)=C.(金刚石,s) △H.﹥0,则金刚石比石墨稳定 C.已知H+(aq)+OH–(aq)=H2O(1) △H.= -57.3kJ·mol-1,则任何酸碱中和的反应热均为57.3 kJ 已知:2C(s)+2O2(g)=2CO2(g) △H.1,2C(s)+O2(g)=2CO(g) △H.2;则△H.1﹤△H.2
已知2SO2(g)+O2  2SO3(g) 为放热反应,则SO2的能量一定高于SO3的能量 已知 (石墨,s)==C(金刚石,s) △H.>0,则金刚石比石墨稳定 C.已知H+(aq)+OH-(aq)=H2O(1) △H=-57.3kJ/mol,则任何酸碱中和的反应热均为57.3 kJ 已知2C(s) +2O2 (g) ==2 CO2(g) △H1 2C(s) +O2 (g) ==2 CO (g) △H2 则△H1<△H2
2SO3(g) 为放热反应,则SO2的能量一定高于SO3的能量 已知 (石墨,s)==C(金刚石,s) △H.>0,则金刚石比石墨稳定 C.已知H+(aq)+OH-(aq)=H2O(1) △H=-57.3kJ/mol,则任何酸碱中和的反应热均为57.3 kJ 已知2C(s) +2O2 (g) ==2 CO2(g) △H1 2C(s) +O2 (g) ==2 CO (g) △H2 则△H1<△H2
已知2SO2(g)+O2  2SO3(g) 为放热反应,则SO2的能量一定高于SO3的能量 已知 (石墨,s)==C(金刚石,s) △H.>0,则金刚石比石墨稳定 C.已知H+(aq)+OH-(aq)=H2O(1) △H.=-57.3kJ·mol-1,则任何酸碱中和的反应热均为57.3 kJ 已知2C(s)+2O2(g)==2 CO2(g) △H.1,2C(s)+O2(g)==2CO(g) △H.2;则△H.1<△H.2
2SO3(g) 为放热反应,则SO2的能量一定高于SO3的能量 已知 (石墨,s)==C(金刚石,s) △H.>0,则金刚石比石墨稳定 C.已知H+(aq)+OH-(aq)=H2O(1) △H.=-57.3kJ·mol-1,则任何酸碱中和的反应热均为57.3 kJ 已知2C(s)+2O2(g)==2 CO2(g) △H.1,2C(s)+O2(g)==2CO(g) △H.2;则△H.1<△H.2
已知2SO2(g)+O2  2SO3(g) 为放热反应,则SO2的能量一定高于SO3的能量 已知 (石墨,s)==C(金刚石,s) △H.>0,则金刚石比石墨稳定 C.已知H+(aq)+OH-(aq)=H2O(1) △H.=-57.3kJ·mol-1,则任何酸碱中和的反应热均为57.3 kJ 已知2C(s)+2O2(g)==2 CO2(g) △H.1,2C(s)+O2(g)==2CO(g) △H.2;则△H.1<△H.2
2SO3(g) 为放热反应,则SO2的能量一定高于SO3的能量 已知 (石墨,s)==C(金刚石,s) △H.>0,则金刚石比石墨稳定 C.已知H+(aq)+OH-(aq)=H2O(1) △H.=-57.3kJ·mol-1,则任何酸碱中和的反应热均为57.3 kJ 已知2C(s)+2O2(g)==2 CO2(g) △H.1,2C(s)+O2(g)==2CO(g) △H.2;则△H.1<△H.2
已知2SO2(g)+O2(g)  2SO3(g)为放热反应,则SO2的能量一定高于SO3的能量 已知 (石墨,s)===C(金刚石,s) ΔH.>0,则金刚石比石墨稳定 C.已知H.+(aq)+OH-(aq)=H2O(l) ΔH.=-57.3 kJ/mol,则任何酸碱中和反应的热效应均为57.3 kJ 已知2C(s)+2O2(g)===2CO2(g) ΔH.1, 2C(s)+O2(g)===2CO(g) ΔH.2,则ΔH.1<ΔH.2
2SO3(g)为放热反应,则SO2的能量一定高于SO3的能量 已知 (石墨,s)===C(金刚石,s) ΔH.>0,则金刚石比石墨稳定 C.已知H.+(aq)+OH-(aq)=H2O(l) ΔH.=-57.3 kJ/mol,则任何酸碱中和反应的热效应均为57.3 kJ 已知2C(s)+2O2(g)===2CO2(g) ΔH.1, 2C(s)+O2(g)===2CO(g) ΔH.2,则ΔH.1<ΔH.2
已知2SO2(g)+O2  2SO3(g)为放热反应,则SO2的能量一定高于SO3的能量 已知 (石墨,s)=C.(金刚石,s) △H.﹥0,则金刚石比石墨稳定 C.已知H+(aq)+OH–(aq)=H2O(1) △H.= -57.3kJ·mol-1,则任何酸碱中和的反应热均为57.3 kJ 已知:2C(s)+2O2(g)=2CO2(g) △H.1,2C(s)+O2(g)=2CO(g) △H.2;则△H.1﹤△H.2
2SO3(g)为放热反应,则SO2的能量一定高于SO3的能量 已知 (石墨,s)=C.(金刚石,s) △H.﹥0,则金刚石比石墨稳定 C.已知H+(aq)+OH–(aq)=H2O(1) △H.= -57.3kJ·mol-1,则任何酸碱中和的反应热均为57.3 kJ 已知:2C(s)+2O2(g)=2CO2(g) △H.1,2C(s)+O2(g)=2CO(g) △H.2;则△H.1﹤△H.2
吸收能量46kJ 吸收能量92kJ 放出能量46kJ 放出能量92kJ
CH30H转变成H2的过程一定要吸收能量 ①反应中,反应物的总能量高于生成物的总能量 根据②推知反应:CH3OH(l)+1/202(g)=CO2(g)+2H2(g) △H>一192.9 kJ/mol 反应②的能量变化如图所示

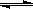 2SO3(g) 为放热反应,则SO2的能量一定高于SO3的能量 已知 (石墨,s)==C(金刚石,s) △H>0,则金刚石比石墨稳定 C.已知H+(aq)+OH-(aq)=H2O(1) △H=-57.3kJ/mol,则任何酸碱中和反应的热效应均为57.3 kJ 已知:2C(s) +2O2 (g) ==2 CO2(g) △H1 2C(s) +O2 (g) ==2 CO (g) △H2 则△H1<△H2
2SO3(g) 为放热反应,则SO2的能量一定高于SO3的能量 已知 (石墨,s)==C(金刚石,s) △H>0,则金刚石比石墨稳定 C.已知H+(aq)+OH-(aq)=H2O(1) △H=-57.3kJ/mol,则任何酸碱中和反应的热效应均为57.3 kJ 已知:2C(s) +2O2 (g) ==2 CO2(g) △H1 2C(s) +O2 (g) ==2 CO (g) △H2 则△H1<△H2

 2SO3(g)为放热反应,则SO2的能量一定高于SO3的能量 已知 (石墨,s)=C.(金刚石,s) △H.﹥0,则金刚石比石墨稳定 C.已知H+(aq)+OH–(aq)=H2O(1) △H.= -57.3kJ·mol-1,则任何酸碱中和的反应热均为57.3 kJ 已知:2C(s)+2O2(g)=2CO2(g) △H.1,2C(s)+O2(g)=2CO(g) △H.2;则△H.1﹤△H.2
2SO3(g)为放热反应,则SO2的能量一定高于SO3的能量 已知 (石墨,s)=C.(金刚石,s) △H.﹥0,则金刚石比石墨稳定 C.已知H+(aq)+OH–(aq)=H2O(1) △H.= -57.3kJ·mol-1,则任何酸碱中和的反应热均为57.3 kJ 已知:2C(s)+2O2(g)=2CO2(g) △H.1,2C(s)+O2(g)=2CO(g) △H.2;则△H.1﹤△H.2
 2SO3(g) 为放热反应,则SO2的能量一定高于SO3的能量 已知 (石墨,s)==C(金刚石,s) △H.>0,则金刚石比石墨稳定 C.已知H+(aq)+OH-(aq)=H2O(1) △H=-57.3kJ/mol,则任何酸碱中和的反应热均为57.3 kJ 已知2C(s) +2O2 (g) ==2 CO2(g) △H1 2C(s) +O2 (g) ==2 CO (g) △H2 则△H1<△H2
2SO3(g) 为放热反应,则SO2的能量一定高于SO3的能量 已知 (石墨,s)==C(金刚石,s) △H.>0,则金刚石比石墨稳定 C.已知H+(aq)+OH-(aq)=H2O(1) △H=-57.3kJ/mol,则任何酸碱中和的反应热均为57.3 kJ 已知2C(s) +2O2 (g) ==2 CO2(g) △H1 2C(s) +O2 (g) ==2 CO (g) △H2 则△H1<△H2
 2SO3(g) 为放热反应,则SO2的能量一定高于SO3的能量 已知 (石墨,s)==C(金刚石,s) △H.>0,则金刚石比石墨稳定 C.已知H+(aq)+OH-(aq)=H2O(1) △H.=-57.3kJ·mol-1,则任何酸碱中和的反应热均为57.3 kJ 已知2C(s)+2O2(g)==2 CO2(g) △H.1,2C(s)+O2(g)==2CO(g) △H.2;则△H.1<△H.2
2SO3(g) 为放热反应,则SO2的能量一定高于SO3的能量 已知 (石墨,s)==C(金刚石,s) △H.>0,则金刚石比石墨稳定 C.已知H+(aq)+OH-(aq)=H2O(1) △H.=-57.3kJ·mol-1,则任何酸碱中和的反应热均为57.3 kJ 已知2C(s)+2O2(g)==2 CO2(g) △H.1,2C(s)+O2(g)==2CO(g) △H.2;则△H.1<△H.2
 2SO3(g) 为放热反应,则SO2的能量一定高于SO3的能量 已知 (石墨,s)==C(金刚石,s) △H.>0,则金刚石比石墨稳定 C.已知H+(aq)+OH-(aq)=H2O(1) △H.=-57.3kJ·mol-1,则任何酸碱中和的反应热均为57.3 kJ 已知2C(s)+2O2(g)==2 CO2(g) △H.1,2C(s)+O2(g)==2CO(g) △H.2;则△H.1<△H.2
2SO3(g) 为放热反应,则SO2的能量一定高于SO3的能量 已知 (石墨,s)==C(金刚石,s) △H.>0,则金刚石比石墨稳定 C.已知H+(aq)+OH-(aq)=H2O(1) △H.=-57.3kJ·mol-1,则任何酸碱中和的反应热均为57.3 kJ 已知2C(s)+2O2(g)==2 CO2(g) △H.1,2C(s)+O2(g)==2CO(g) △H.2;则△H.1<△H.2
 2SO3(g)为放热反应,则SO2的能量一定高于SO3的能量 已知 (石墨,s)===C(金刚石,s) ΔH.>0,则金刚石比石墨稳定 C.已知H.+(aq)+OH-(aq)=H2O(l) ΔH.=-57.3 kJ/mol,则任何酸碱中和反应的热效应均为57.3 kJ 已知2C(s)+2O2(g)===2CO2(g) ΔH.1, 2C(s)+O2(g)===2CO(g) ΔH.2,则ΔH.1<ΔH.2
2SO3(g)为放热反应,则SO2的能量一定高于SO3的能量 已知 (石墨,s)===C(金刚石,s) ΔH.>0,则金刚石比石墨稳定 C.已知H.+(aq)+OH-(aq)=H2O(l) ΔH.=-57.3 kJ/mol,则任何酸碱中和反应的热效应均为57.3 kJ 已知2C(s)+2O2(g)===2CO2(g) ΔH.1, 2C(s)+O2(g)===2CO(g) ΔH.2,则ΔH.1<ΔH.2
 2SO3(g)为放热反应,则SO2的能量一定高于SO3的能量 已知 (石墨,s)=C.(金刚石,s) △H.﹥0,则金刚石比石墨稳定 C.已知H+(aq)+OH–(aq)=H2O(1) △H.= -57.3kJ·mol-1,则任何酸碱中和的反应热均为57.3 kJ 已知:2C(s)+2O2(g)=2CO2(g) △H.1,2C(s)+O2(g)=2CO(g) △H.2;则△H.1﹤△H.2
2SO3(g)为放热反应,则SO2的能量一定高于SO3的能量 已知 (石墨,s)=C.(金刚石,s) △H.﹥0,则金刚石比石墨稳定 C.已知H+(aq)+OH–(aq)=H2O(1) △H.= -57.3kJ·mol-1,则任何酸碱中和的反应热均为57.3 kJ 已知:2C(s)+2O2(g)=2CO2(g) △H.1,2C(s)+O2(g)=2CO(g) △H.2;则△H.1﹤△H.2
