你可能感兴趣的试题
反应过程可表示为 E.1为反应物的平均能量与过渡态的能量差,称为正反应的活化能 正反应的热效应为ΔH=E.1-E.2<0,所以正反应为放热反应 此图中逆反应的热效应ΔH=E.1-E.2<0,所以逆反应为放热反应
该反应为放热反应 催化剂能降低该反应的活化能 催化剂能改变该反应的焓变 逆反应的活化能大于正反应的活化能 
该反应为放热反应 催化剂能改变该反应的焓变 催化剂能降低该反应的活化能 逆反应的活化能大于正反应的活化能
该反应为放热反应 催化剂能改变该反应的焓变 催化剂能降低该反应的活化能 逆反应的活化能大于正反应的活化能
该反应为放热反应 催化剂能降低反应的活化能 催化剂能改变反应的焓变 逆反应的活化能大于正反应的活化能
该反应为放热反应 催化剂能改变该反应的焓变 催化剂能降低该反应的活化能 逆反应的活化能大于正反应的活化能
该反应为放热反应 升高温度,不影响活化分子百分数 催化剂能降低该反应的活化能 逆反应的活化能等于正反应的活化能
该反应为放热反应 催化剂能改变反应的焓变 催化剂能降低反应的活化能 逆反应的活化能大于正反应的活化能
反应过程可表示为A.+BC—→[A… … ] —→AB+C(反应物)(过渡态) (产物)B.此图中逆反应的热效应△H=E1—E2,为吸热反应C.正反应的热效应为△H=E1—E2,且E2>E1,所以正反应为放热反应 E1为反应物的平均能量与过渡态的能量差,称为正反应的活化能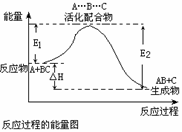
该反应的正反应为吸热反应 催化剂能改变反应的焓变 催化剂不能降低反应的活化能 逆反应的活化能大于正反应的活化能 
该反应为放热反应 催化剂能降低反应的活化能 催化剂能改变反应的焓变 逆反应的活化能大于正反应的活化能
反应过程可表示为 A.+BC—→[A…B…C] —→AB+C (反应物) (过渡态) (产物) E1为反应物的平均能量与过渡态的能量差,称为正 反应的活化能 此图中正反应的热效应为△H=E1—E2,且E2>E1, 所以正反应为放热反应 此图中逆反应的热效应△H=E1—E2,为吸热反应
该反应为放热反应 催化剂能改变该反应的焓变 催化剂能降低该反应的活化能 逆反应的活化能大于正反应的活化能
反应过程可表示为 E.1为反应物的平均能量与过渡态的能量差,称为正反应的活化能 正反应的热效应为ΔH=E.1-E.2<0,所以正反应为放热反应 此图中逆反应的热效应ΔH=E.1-E.2<0,所以逆反应为放热反应
该反应为放热反应 催化剂能改变该反应的焓变 催化剂能降低该反应的活化能 逆反应的活化能大于正反应的活化能
反应过程可表示为A.+BC—→[A… … ] —→AB+C (反应物) (过渡态) (产物) B.E1为反应物的平均能量与过渡态的能量差,称为正反应的活化能 C.正反应的热效应为△H.=E1—E2,且E2>E1,所以正反应为放热反应 此图中逆反应的热效应△H.=E1—E2,为吸热反应 
该反应为放热反应 催化剂能改变该反应的焓变 催化剂能降低该反应的活化能 逆反应的活化能大于正反应的活化能
催化剂能改变该反应的焓变 催化剂能降低该反应的活化能 逆反应的活化能大于正反应的活化能 该反应为放热反应
1 mo N2与3 mo H2反应可以放出92 kJ的热量 b曲线是加入催化剂时的能量变化曲线 加入催化剂,该反应的焓变减小 正反应的活化能等于逆反应的活化能 






