你可能感兴趣的试题
NaOH溶液与三种酸的反应均是吸热反应 酸性强弱: HX>HY>HZ 滴定酸HY可用酚酞作指示剂 滴定三种酸都可用甲基橙作指示剂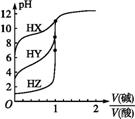
Na2CO3、NaHCO3两种盐的溶液中,离子种类不相同 常温下1mol・LCH3COOH溶液与1mol/NaOH溶液等体积混合,所得溶液中c(Na+)>c(CH3COO-)>c(H+)>c(OH-) 溶质的物质的量浓度相同时NH4C.1和NH4HSO4两种溶液中c(NH4+)前者小于后者 常温下,某溶液中由水电离出的c(H+)为10-5mol/L,则此溶液可能是盐酸
常温下测定两溶液的导电能力,导电能力强的是浓硫酸 常温下可以用铜片鉴别两种溶液 铝片不能用于鉴别两种溶液 两溶液敞口在空气中放置一段时间后质量明显增大的是浓硫酸
0.1m0l/1NaCl水溶液 0.1mol/l蔗糖水溶液 0.1mol/l HAc水溶液 0.1m01/1CaCl2水溶液
两种溶液中,由水电离出的氢离子浓度均为1×10-11 mol/L 分别加水稀释100倍后,两种溶液的pH仍相同 醋酸中的c(CH3COO-)和硫酸中的c(SO )相等 分别加入足量锌片,两种溶液生成H2的体积相同
)相等 分别加入足量锌片,两种溶液生成H2的体积相同
1×(10-14+10-10) mol·L-1  mol·L-1 2×10-13 mol·L-1 2×10-14 mol·L-1
mol·L-1 2×10-13 mol·L-1 2×10-14 mol·L-1
Na2CO3、NaHCO3两种盐溶液中,离子种类相同 常温下,1 mol·L-1的CH3COOH溶液与1 mol·L-1的NaOH溶液等体积混合后,所得混合液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) 物质的量浓度相同的NH4Cl和NH4HSO4两种溶液中,c(NH4+)前者大于后者 常温下,某溶液中由水电离出的c(H+)=10-5 mol·L-1,则此溶液可能是盐酸
两种溶液中,由水电离出的氢离子浓度均为l×10-11 mol·L-1
分别加水稀释100倍后,两种溶液的pH仍相等
中和同体积的这两种酸溶液所需要NaOH物质的量也相等
分别加入足量锌片,两种溶液生成H2的体积相等
两种溶液中,由水电离出的氢离子浓度均为1×10-11 mol•L-1 分别加水稀释100倍后,两种溶液的pH仍相同 醋酸溶液中的c(CH3COO-)和硫酸中的c(SO42-)相等 分别加入足量锌片,两种溶液生成H2的体积相同
c(H+):①>② 分别加入1L 0.1mol·L-1HCl溶液后,两溶液的pH:①<② 分别加入等浓度的盐酸至溶液呈中性,消耗盐酸的体积:①<② n(HF)+n(F)=n(HClO)+n(ClO)
两种溶液中,由水电离出的氢离子浓度均为l×10-11 mol·L-1
分别加水稀释100倍后,两种溶液的pH仍相等 中和同体积的这两种酸溶液所需要NaOH物质的量相等
分别加入足量锌片,两种溶液生成H2的体积相等
HX、HY都是弱酸,且HX的酸性比HY的弱 常温下,由水电离出的c(H+)·c(OH-):a相同温度下,电离常数K.(HX):a>b lg =3,若同时微热两种溶液(不考虑HX、HY和H2O的挥发),则
=3,若同时微热两种溶液(不考虑HX、HY和H2O的挥发),则 减小
减小
常温下,pH等于14与pH等于12的两种NaOH溶液等体积混合后, c(H+)=(10-14+10-10)/2 常温下,浓度为1×10-10 mol·L.-1的KOH溶液的pH为7 氨水加水稀释,溶液中除水以外的所有粒子的浓度都减小 常温下,pH等于1的盐酸溶液中水的电离程度与pH等于13的Ba(OH)2溶液中水的电离程度相等


 )相等 分别加入足量锌片,两种溶液生成H2的体积相同
)相等 分别加入足量锌片,两种溶液生成H2的体积相同
 mol·L-1 2×10-13 mol·L-1 2×10-14 mol·L-1
mol·L-1 2×10-13 mol·L-1 2×10-14 mol·L-1
 =3,若同时微热两种溶液(不考虑HX、HY和H2O的挥发),则
=3,若同时微热两种溶液(不考虑HX、HY和H2O的挥发),则 减小
减小