你可能感兴趣的试题
MOH为一元强碱,HA为一元强酸 K点对应的溶液中:c(M+)+c(MOH)=c(A-) K点对应的溶液中:c(MOH)+c(OH-)-c(H+)=0.005mol·L-1 N点水的电离程度小于K.点水的电离程度
原HA溶液中,c(H+)= c(A.﹣) 当恰好完全中和时,溶液呈中性 当NaOH溶液过量时,可能出现:c(A.﹣)>c(Na+)>c(OH﹣)>c(H+) 当滴入少量的NaOH,促进了HA的电离,溶液的pH升高
常温下,20mL中含X.、Y.各0.003mol的溶液 常温下,100mL中含X.、Y.各0.005mol的溶液 常温下,0.1mol/L.的X.、Y.溶液各l0mL相混合 标准状况下,0.1mol/L.的X.、Y.溶液各l0mL相混合
1mol/L 1.5mol/L 3mol/L 6mol/L
MOH为一元强碱,HA为一元强酸 K点对应的溶液中:c(M+)+c(MOH)=c(A-) K点对应的溶液中:c(MOH)+c(OH-)-c(H+)=0.005mol·L-1 N点水的电离程度小于K.点水的电离程度
由a→b,HA 电离断键时放出热量
c点溶液中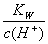 >3×10-3mol/L
>3×10-3mol/L
由d→e,溶液中c(H+)增大,a(HA)减小
e 点溶液中一定有c(H+)>c(HA)
HA为一元强酸 MOH为一元弱碱 N点水的电离程度小于K点水的电离程度 K点对应的pH=10,则有c (MOH)+ c(OH-)-c (H+)=0.005mol·L-1
由题可知HA为弱酸 滴定终点位于c和d这间 滴定到b点时:n(Na+)+n(H.+)-n(OH-)+n(HA)=0.002mol 滴定到d点时:c(OH-)>c(Na+)>c(A.-)>c(H.+)
0.25mol/L 2mol/L 1mol/L 0.5 mol/L
HA为一元强酸 MOH为一元弱碱 N点水的电离程度小于K.点水的电离程度 若K.点对应的溶液的pH=10,则有c(MOH)+c(OH-)-c(H+)=0.005 mol·L-1

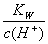 >3×10-3mol/L
>3×10-3mol/L