你可能感兴趣的试题
0.1 mol锌片投入到100 mL 1 mol・L-1的盐酸溶液中 1 mol MnO2粉末与400 mL10 mol・L-1的盐酸共热 常温下1mol铝片投入到200mL18.4mol・L-1硫酸中 常温下 1 mol铜片投入含4molHNO3的浓硝酸中
为弱酸,下列说法错误的是
A.0.1mol/L的Na2A溶液中:c(A2-)+c(HA-)+ c(H2A.)= 0.1mol/L 常温下,将pH=3的H2A溶液稀释到原来的100倍,则稀释后溶液的pH<5
常温下,将pH=3的H2A溶液与pH=11的NaOH溶液等体积混合,反应混合液呈酸性
常温下,若1mol/L的NaHA溶液的pH=9,则溶液中:c(Na+)-c(HA-)-c(A2-)=10-5-10-9
①溶液中:c(A-)>c(Na+)>c(OH-)>c(H+) ①溶液中:c(HA)+c(A-)=0.1mol/L 常温下,0.1mol/LHA溶液的pH=1 0.1mol/LHA溶液中:c(HA)>c(A-)
MOH为一元强碱,HA为一元强酸 K点对应的溶液中:c(M+)+c(MOH)=c(A-) K点对应的溶液中:c(MOH)+c(OH-)-c(H+)=0.005mol·L-1 N点水的电离程度小于K.点水的电离程度
常温下,20mL中含X.、Y.各0.003mol的溶液 常温下,100mL中含X.、Y.各0.005mol的溶液 常温下,0.1mol/L.的X.、Y.溶液各l0mL相混合 标准状况下,0.1mol/L.的X.、Y.溶液各l0mL相混合
HA的酸性强于HB的酸性 V.(酸)=10mL时,两份溶液中c(B−)=c(A−) a 点时,c(A−)>c(Na+)>c(OH−)>c(H+) b、c点时,c(A−)+c(HA)=2c(Na+)=c(HB)+c(B−)
由a→b,HA 电离断键时放出热量
c点溶液中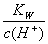 >3×10-3mol/L
>3×10-3mol/L
由d→e,溶液中c(H+)增大,a(HA)减小
e 点溶液中一定有c(H+)>c(HA)
HA为一元强酸 MOH为一元弱碱 N点水的电离程度小于K点水的电离程度 K点对应的pH=10,则有c (MOH)+ c(OH-)-c (H+)=0.005mol·L-1
由题可知HA为弱酸 滴定终点位于c和d这间 滴定到b点时:n(Na+)+n(H.+)-n(OH-)+n(HA)=0.002mol 滴定到d点时:c(OH-)>c(Na+)>c(A.-)>c(H.+)
常温下,该酸的电离常数K=10-5.6 该测定过程中不可以选择甲基橙为指示剂 离定至①处时,溶液中离子浓度关系为: c(A-)>c(Na+)>c(H+)>c(OH-) 由①到③过程中,水的电离程度先增大后减小
常温下,该酸的电离常数K=10-5.6 该测定过程中不可以选择甲基橙为指示剂 离定至①处时,溶液中离子浓度关系为: c(A-)>c(Na+)>c(H+)>c(OH-) 由①到③过程中,水的电离程度先增大后减小
HA为一元强酸 MOH为一元弱碱 N点水的电离程度小于K.点水的电离程度 若K.点对应的溶液的pH=10,则有c(MOH)+c(OH-)-c(H+)=0.005 mol·L-1

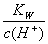 >3×10-3mol/L
>3×10-3mol/L