你可能感兴趣的试题
Q=Q1=Q2 Q=Q1+Q2 H=H1=H2 以上选项都不符合
放出的热量为(0.4Q1+0.1Q3)KJ 放出的热量为(0.4Q1+0.05Q2)KJ 放出的热量为(0.4Q1+0.05Q3)KJ △H2 <△H3
k=*q1*(*q2); q1=k; q1=q2; k=*q1+*q2;
Q1>0,Q2>0 Q2<0,Q3<0 Q1>0,Q3>0 Q.2>0,Q.3>0
k=*q1+*q2; q1=k; q1=q2; k=*q1*(*q2);
Q2>Q1/2 Q2=Q1/2 Q2<Q1<197kJ Q2=Q1=197kJ
放出的热量为(0.4Q1+0.05Q3)KJ/mol 放出的热量为(0.4Q1+0.05Q2)KJ/mol △H2 > △H3 △H2 <△H3
H总=H1—H2 H总=H2—H1 H总=H1=H2 H总=H1+H2
k=*q1*(*q2); q1=k; q1=q2; k=*q1+*q2;
k=*q1+*q2; q1=k; q1=q2; k=*q1*(*q2);
Q1+Q2+Q3 0.5Q3-Q2+2Q1 0.5Q3+Q2-2Q1 0.5(Q1+Q2+Q3)
2Q1>O2 Q1>2Q2 2Q1<Q2 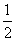 Q2=Q1
Q2=Q1
Q2>Q1>Q3 Q1>Q3>Q2 Q3>Q2>Q1 Q1>Q2>Q3
25℃ 101kPa时,CH4(g)+2O2(g)=CO2(g) +2H2O(g) △H=-Q kJ/mol, 则甲烷的燃烧热为Q kJ/mol CaCO3(s)=CaO(s)+CO2(g) 室温下不能自发进行,说明该反应的 ΔH<0 反应N2(g)+3H2(g) 2NH3(g)ΔH<0达到平衡后,升高温度,反 应速率v(H2)和H2的平衡转化率均增大 已知氯气、溴蒸气分别跟氢气反应的热化学方程式如下(Q1、Q2的值 均大于零): H2(g) +Cl2(g)=2HCl(g) △H1=—Q1 kJ/mol H2(g) +Br2(g)=2HBr(g) △H2=—Q2 kJ/mol 则△H1<△H2
2NH3(g)ΔH<0达到平衡后,升高温度,反 应速率v(H2)和H2的平衡转化率均增大 已知氯气、溴蒸气分别跟氢气反应的热化学方程式如下(Q1、Q2的值 均大于零): H2(g) +Cl2(g)=2HCl(g) △H1=—Q1 kJ/mol H2(g) +Br2(g)=2HBr(g) △H2=—Q2 kJ/mol 则△H1<△H2
2H2(g)+O2(g)=2H2O(g) ∆H1=-Q1KJ/mol , 2H2(g)+O2(g)=2H2O(l) ∆H2=-Q2KJ/mol C(金刚石)+O2(g)=CO2(g) ∆H1 =-Q1KJ/mol , C(石墨)+O2(g)= CO2(g) ∆H2 =-Q2KJ/mol S(s)+O2(g)=SO2(g) ∆H1 =-Q1KJ/mol , S(g)+O2(g)=SO2(g) ∆H2 = -Q2KJ/mol C(金刚石)+0.5O2(g)=CO(g) ∆H1 =-Q1KJ/mol , C(金刚石)+O2(g)=CO2(g) ∆H2 = -Q2KJ/mol
Q1>Q2>Q3 Q1>Q3>Q2 Q3>Q2>Q1 Q2>Q1>Q3

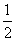 Q2=Q1
Q2=Q1
 2NH3(g)ΔH<0达到平衡后,升高温度,反 应速率v(H2)和H2的平衡转化率均增大 已知氯气、溴蒸气分别跟氢气反应的热化学方程式如下(Q1、Q2的值 均大于零): H2(g) +Cl2(g)=2HCl(g) △H1=—Q1 kJ/mol H2(g) +Br2(g)=2HBr(g) △H2=—Q2 kJ/mol 则△H1<△H2
2NH3(g)ΔH<0达到平衡后,升高温度,反 应速率v(H2)和H2的平衡转化率均增大 已知氯气、溴蒸气分别跟氢气反应的热化学方程式如下(Q1、Q2的值 均大于零): H2(g) +Cl2(g)=2HCl(g) △H1=—Q1 kJ/mol H2(g) +Br2(g)=2HBr(g) △H2=—Q2 kJ/mol 则△H1<△H2