你可能感兴趣的试题
常温下,等浓度、等体积的NaHCO3 溶液pH小于 溶液pH 常温下,等浓度、等体积的Na2 CO3 溶液和
溶液pH 常温下,等浓度、等体积的Na2 CO3 溶液和  溶液中所含离子总数前者小于后者
溶液中所含离子总数前者小于后者  水杨酸的第二级电离 Ka2 远小于第一级电离Ka1 的原因之一是 能形成分子内氢键
水杨酸的第二级电离 Ka2 远小于第一级电离Ka1 的原因之一是 能形成分子内氢键
向含有CaCO3沉淀的水中通入CO2至沉淀恰好溶解,再向溶液中加入NaHCO3饱和溶液, 又有CaCO3沉淀生成 向Na2 CO3溶液中逐滴加入等物质的量的稀盐酸,生成的CO2与原溶液中Na2CO3的物质 的量之比为1:2 等质量的NaHCO3和Na2 CO3分别与足量稀盐酸反应,在同温同压下,生成的CO2体积相同 向Na2CO3饱和溶液中通入足量CO2,有NaHCO3 结晶析出
大黄酸 大黄素 芦荟大黄素 大黄酚 大黄素葡萄糖苷
可用澄清石灰水鉴别这两种物质 Na2CO3比NaHCO3更稳定 相同条件下 Na2CO3溶液碱性比NaHCO3 强 等物质的量的Na2CO3和NaHCO3与足量盐酸反应生成的二氧化碳质量相等
[Co(ONO)(NH3)5]SO4硫酸一亚硝酸•五氨根合钴(III) [Co(NH3)5H2O]Cl3三氯化一水•五氨合钴(Ⅲ) [PtCl(NO2)(NH3)4]CO3碳酸一硝基•一氯•四氨合铂(IV) [CrBr2(H2O)4]Br∙2H2O二水合溴化二溴•四水合铬(III)
(3)>(2)>(4)>(1) (4)>(2)>(3)>(1) (4)>(3)>(2)>(1) (1)>(2)>(3)>(4)
溶液的pH不变 溶液中Na2CO3的物质的量不变 Na2CO3溶液的浓度不变 Na2CO3的水解程度不变
CaO MgO CaMgO2 CaMg(CO3)2
Al(HCO3)3+Na2SO4 Al2(CO3)3+Na2SO4 Na2SO4+Al2(CO3)3+CO2↑ Al(OH)3↓+CO2↑+Na2SO4
CaO.Mg(CO3)2 CaO.MgO CaO.MgCO3
常温下,等浓度、等体积的NaHCO3 溶液pH小于 溶液pH 常温下,等浓度、等体积的Na2 CO3 溶液和
溶液pH 常温下,等浓度、等体积的Na2 CO3 溶液和 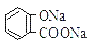 溶液中所含离子总数前者小于后者
溶液中所含离子总数前者小于后者 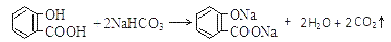 水杨酸的第二级电离 Ka2 远小于第一级电离Ka1 的原因之一是 能形成分子内氢键
水杨酸的第二级电离 Ka2 远小于第一级电离Ka1 的原因之一是 能形成分子内氢键
降低、CO2、Na2CO3 降低、乳酸、NaHCO3 升高、CO2、H2CO3 升高、乳酸、NaHCO3
K+ 、Ca 2+ 、Mg 2+ Na + 、Ca 2+ 、Mg 2+ Na + 、K + 、Mg 2+ Na + 、K + 、Ca 2+ 、Mg 2+
Cl- 、SO4^2- 、CO3^2- 、CHO3- SO4^2- 、CO3^2- 、CHO3- Cl - 、CO3^2- 、CHO3- Cl - 、CHO3-
HA C-NaA C NH3 -NH 4 Cl H CO3— Na2 CO3 H2 CO3 -Na2 CO3
CO2 CP PaCO2 HCO3 - HCO3- 与H2CO3 的比值 H2 CO3
5%Na2 CO3溶液 . 5%NaHCO3溶液 5%NaOH溶液 1%NaOH溶液 1%NaHCO3溶液
o—a段反应的化学方程式是:Ba(OH)2 + CO2 = Ba CO3↓+ H2O  b—c段反应的离子方程式是:2AlO2-+ 3H2O+ CO2=2Al(OH)3↓+ CO32- a—b段与c—d段所发生的反应相同 d—e段沉淀的减少是由于碳酸钡固体的消失所致
b—c段反应的离子方程式是:2AlO2-+ 3H2O+ CO2=2Al(OH)3↓+ CO32- a—b段与c—d段所发生的反应相同 d—e段沉淀的减少是由于碳酸钡固体的消失所致

 溶液pH 常温下,等浓度、等体积的Na2 CO3 溶液和
溶液pH 常温下,等浓度、等体积的Na2 CO3 溶液和  溶液中所含离子总数前者小于后者
溶液中所含离子总数前者小于后者  水杨酸的第二级电离 Ka2 远小于第一级电离Ka1 的原因之一是 能形成分子内氢键
水杨酸的第二级电离 Ka2 远小于第一级电离Ka1 的原因之一是 能形成分子内氢键
 溶液pH 常温下,等浓度、等体积的Na2 CO3 溶液和
溶液pH 常温下,等浓度、等体积的Na2 CO3 溶液和 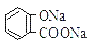 溶液中所含离子总数前者小于后者
溶液中所含离子总数前者小于后者 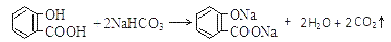 水杨酸的第二级电离 Ka2 远小于第一级电离Ka1 的原因之一是 能形成分子内氢键
水杨酸的第二级电离 Ka2 远小于第一级电离Ka1 的原因之一是 能形成分子内氢键
 b—c段反应的离子方程式是:2AlO2-+ 3H2O+ CO2=2Al(OH)3↓+ CO32- a—b段与c—d段所发生的反应相同 d—e段沉淀的减少是由于碳酸钡固体的消失所致
b—c段反应的离子方程式是:2AlO2-+ 3H2O+ CO2=2Al(OH)3↓+ CO32- a—b段与c—d段所发生的反应相同 d—e段沉淀的减少是由于碳酸钡固体的消失所致