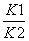你可能感兴趣的试题
H2A在水溶液中的电离方程式为:H2A=H++HA-,HA- H++A2- 常温下,NH4HA溶液中滴加NaOH溶液至溶液pH=7,则c(Na+) = 2c(A2-) 相同条件下,体积相等、pH相等的盐酸与H2A溶液中和NaOH的量相等 0.0l mol·L-l的NaHA溶液pH>2
H++A2- 常温下,NH4HA溶液中滴加NaOH溶液至溶液pH=7,则c(Na+) = 2c(A2-) 相同条件下,体积相等、pH相等的盐酸与H2A溶液中和NaOH的量相等 0.0l mol·L-l的NaHA溶液pH>2
K≤1.0×10-6㎜/S K≤1.0×10-7㎜/S K≤1.0×10-8㎜/S K≤1.0×10-9㎜/S
c(OH-)=2×10-7 mol/L c(OH-)=5×10-8 mol/L 无法确定OH-浓度 该温度低于室温
H+、Cl-、SO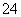 、K+ K+、H+、Na+、HCO
、K+ K+、H+、Na+、HCO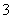 Cu2+、K+、SO
Cu2+、K+、SO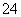 、Cl- Ag+、NO
、Cl- Ag+、NO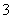 、Cl-、K+
、Cl-、K+
K2Cr2O7+浓H2SO4 K2Cr2O7+浓HCl K2Cr2O4+浓H2SO4 K2Cr2O4+浓HCl
K.1+K.2 K.1-K.2 K.1×K.2 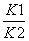
2△H.和2K -2△H.和 K2 -2△H.和 K-2 2△H.和-2K
该溶液的pH=4 升高温度,溶液的pH增大 此酸的电离平衡常数约为1×10-7 由HA电离出的c(H.+)约为水电离出的c(H.+)的106倍
H2SO3(Ka1=1.3×10-2、Ka2=6.3×10-8) H2CO3(Ka1=4.2×10-7、Ka2=5.6×10-11) H2SO4(Ka1≥1、Ka2=1.2×10-2) H2C2O4(Ka1=5.9×10-2、Ka2=6.4×10-5)
H2SO3(Ka1=1.3×10-2;Ka2=6.3×10-8) H2CO3(Ka1=4.2×10-7;Ka2=5.6×10-11) H2C2O4(Ka1=5.9×10-2;Ka2=6.4×10-5) H3PO3(Ka1=5.0×10-2;Ka2=2.5×10-7)
K2CrO4+H2SO4 K2CrO4+浓HCL K2Cr2O7+浓HCL K2Cr2O7+浓H2SO4 K2Cr2O7+浓HNO3

 H++A2- 常温下,NH4HA溶液中滴加NaOH溶液至溶液pH=7,则c(Na+) = 2c(A2-) 相同条件下,体积相等、pH相等的盐酸与H2A溶液中和NaOH的量相等 0.0l mol·L-l的NaHA溶液pH>2
H++A2- 常温下,NH4HA溶液中滴加NaOH溶液至溶液pH=7,则c(Na+) = 2c(A2-) 相同条件下,体积相等、pH相等的盐酸与H2A溶液中和NaOH的量相等 0.0l mol·L-l的NaHA溶液pH>2
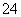 、K+ K+、H+、Na+、HCO
、K+ K+、H+、Na+、HCO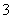 Cu2+、K+、SO
Cu2+、K+、SO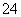 、Cl- Ag+、NO
、Cl- Ag+、NO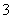 、Cl-、K+
、Cl-、K+