

 x (g)在不同温度和压强下,反应物A.的转化率变化情况。下列判断正确的是 ( )A.m>x,正反应为放热反应B.m+n<x,正反应为吸热反应C.m<x,正反应为放热反应 m>x,正反应为吸热反应
x (g)在不同温度和压强下,反应物A.的转化率变化情况。下列判断正确的是 ( )A.m>x,正反应为放热反应B.m+n<x,正反应为吸热反应C.m<x,正反应为放热反应 m>x,正反应为吸热反应

 p (g)+q (g),如图是表示A.的转化率与压强、温度的关系,分析下图可以得出的正确结论是 A.正反应是吸热反应,且m+n>p+q B.正反应是吸热反应,且m+n
p (g)+q (g),如图是表示A.的转化率与压强、温度的关系,分析下图可以得出的正确结论是 A.正反应是吸热反应,且m+n>p+q B.正反应是吸热反应,且m+n x (g)在不同温度和压强下,反应物A.的转化率变化情况。下列判断正确的是 ( ) A.m>x,正反应为放热反应 B.m+n<x,正反应为吸热反应 C.m<x,正反应为放热反应 m>x,正反应为吸热反应
x (g)在不同温度和压强下,反应物A.的转化率变化情况。下列判断正确的是 ( ) A.m>x,正反应为放热反应 B.m+n<x,正反应为吸热反应 C.m<x,正反应为放热反应 m>x,正反应为吸热反应
 N2O4(正反应为放热反应) C.(s)+CO2
N2O4(正反应为放热反应) C.(s)+CO2 2CO(正反应为吸热反应) N2+3H2
2CO(正反应为吸热反应) N2+3H2 2NH3(正反应为放热反应) H2S
2NH3(正反应为放热反应) H2S H2+S(s)(正反应为吸热反应)
H2+S(s)(正反应为吸热反应)
 2O3(g)(正反应为吸热反应) 2NO2(g)
2O3(g)(正反应为吸热反应) 2NO2(g) N2O4(g) (正反应为放热反应) NH4HCO3(s)
N2O4(g) (正反应为放热反应) NH4HCO3(s) NH3(g)+CO2(g)+H2O(g) (正反应为吸热反应) H2(g)+I2(g)
NH3(g)+CO2(g)+H2O(g) (正反应为吸热反应) H2(g)+I2(g) 2HI(g) (正反应为放热反应)
2HI(g) (正反应为放热反应)
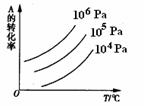 化率与压强、温度的关系。下列叙述正确的是( ) A.正反应是放热反应;m+n>p+q 正反应是吸热反应;m+n<P+q 正反应是放热反应;m+n<p+q 正反应是吸热反应;m+n>p+q
化率与压强、温度的关系。下列叙述正确的是( ) A.正反应是放热反应;m+n>p+q 正反应是吸热反应;m+n<P+q 正反应是放热反应;m+n<p+q 正反应是吸热反应;m+n>p+q
 2HI(正反应为放热反应) 2NO2(g)
2HI(正反应为放热反应) 2NO2(g)  N2O4(g)(正反应为放热反应) CO2(g)+C(s)
N2O4(g)(正反应为放热反应) CO2(g)+C(s)  2CO(g) (正反应为吸热反应) 4NH3(g)+5O2(g)
2CO(g) (正反应为吸热反应) 4NH3(g)+5O2(g)  4NO(g)+6H2O(g) (正反应为放热反应)
4NO(g)+6H2O(g) (正反应为放热反应)
 N2O4(正反应为放热反应) C.(s)+CO2
N2O4(正反应为放热反应) C.(s)+CO2 2CO(正反应为吸热反应) N2+3H2
2CO(正反应为吸热反应) N2+3H2 2NH3(正反应为放热反应) H2S
2NH3(正反应为放热反应) H2S H2+S(s)(正反应为吸热反应)
H2+S(s)(正反应为吸热反应)
 N2O4 (正反应为放热反应) C.(s)+ CO2
N2O4 (正反应为放热反应) C.(s)+ CO2  2CO (正反应为吸热反应) N2 + 3H2
2CO (正反应为吸热反应) N2 + 3H2  2NH3 (正反应为放热反应) H2S
2NH3 (正反应为放热反应) H2S  H2 +S.(s)(正反应为吸热反应)
H2 +S.(s)(正反应为吸热反应)