你可能感兴趣的试题
c (A-)>c (B+)>c (H+)>c (OH-) c (B+)=c (A-)>c (H+)=c (OH-) c (OH-)- c (H+)=c(HA) c (B+)+ c (H+)=c (A-)+c (OH-) + c(HA)
甲:反应后溶液中 c(Na+) > c(A-)> c(OH-) > c(H+) 乙:反应后溶液中 c(Na+) = c(HA) + c(A-) 甲中由水电离产生的c(H+) = 1×10-9 mol·L-1 乙中c1一定大于0.2 mol·L-1
HA为强 该混合溶液的pH=7.0 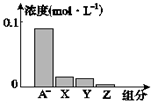 该混合溶液中c(Aˉ)+c(Y)=c(Na+) 图中X.表示HA,Y.表示OH-,Z.表示H+
该混合溶液中c(Aˉ)+c(Y)=c(Na+) 图中X.表示HA,Y.表示OH-,Z.表示H+
若混合前酸、碱pH之和等于14,则HA一定是弱酸 若混合前酸、碱物质的量浓度相同,则BOH一定是弱碱 溶液中水的电离程度:混合溶液>纯水>BOH溶液 混合溶液中离子浓度一定满足:c(B+)>c(A-)>c(H+)>c(OH-)
c1一定大于0.2 mol·L-1 HA的电离方程式是HA H.++A.- 甲反应后溶液中:c(Na+)>c(OH-)>c(A-)>c(H+) 乙反应后的溶液中:c(Na+)<c(HA)+c(A-)
H.++A.- 甲反应后溶液中:c(Na+)>c(OH-)>c(A-)>c(H+) 乙反应后的溶液中:c(Na+)<c(HA)+c(A-)
①溶液中:c(A-)>c(Na+)>c(OH-)>c(H+) ①溶液中:c(HA)+c(A-)=0.1mol/L 常温下,0.1mol/LHA溶液的pH=1 0.1mol/LHA溶液中:c(HA)>c(A-)
c(B+)=c(A-)>c(OH-)>c(H+) c(A-)>c(B+)>c(H+)>c(OH-) c(B+)+c(H+)=c(A-)+c(OH-) c(B+)>c(A-)>c(H+)>c(OH-)
HA的酸性强于HB的酸性 V.(酸)=10mL时,两份溶液中c(B−)=c(A−) a 点时,c(A−)>c(Na+)>c(OH−)>c(H+) b、c点时,c(A−)+c(HA)=2c(Na+)=c(HB)+c(B−)
HA的电离方程式为: 不考虑其他组的实验结果,
不考虑其他组的实验结果, ③组实验中,混合溶液中
③组实验中,混合溶液中 ①组实验中,混合溶液中
①组实验中,混合溶液中
该一元酸溶液浓度为0.10 mol·L-1 a、b、c点的水溶液导电性依次增强 室温时,HA的电离常数Ka≈l×10-5 a点和c点所示溶液中H2O的电离程度相同
HA的酸性强于HB的酸性 V.(酸)=10mL时,两份溶液中c(B−)=c(A−) a 点时,c(A−)>c(Na+)>c(OH−)>c(H+) b、c点时,c(A−)+c(HA)=2c(Na+)=c(HB)+c(B−)
该一元酸溶液的pH=1 该溶液中由水电离出的c(H+)=1×10-11mol・L.―1 该溶液中水的离子积常数为1×10-22 用pH=11的NaOH溶液V1L与V2L0.1 mol・L.―1该一元酸(HA)溶液混合,若混合 溶液的pH=7,则V1<V2
0.1mol·L-1的HA溶液中由水电离出的c(H+)> 1×10-13mol/L c1一定大于0.2 mol·L-1 甲反应后的溶液中:HA占含A-微粒总数的0.01%  乙反应后的溶液中:c(Na+) < c(HA) + c(A-)
乙反应后的溶液中:c(Na+) < c(HA) + c(A-)
常温下,该酸的电离常数K=10-5.6 该测定过程中不可以选择甲基橙为指示剂 离定至①处时,溶液中离子浓度关系为: c(A-)>c(Na+)>c(H+)>c(OH-) 由①到③过程中,水的电离程度先增大后减小
若混合前酸、碱溶液的pH之和等于14,则HA是强酸
若酸、碱溶液的物质的量浓度相等,则BOH是弱碱
水的电离程度:混合溶液>纯水>BOH溶液
混合后溶液中的离子浓度关系:c(B+)>c(A-)>c(H+)>c(OH-)
常温下,该酸的电离常数K=10-5.6 该测定过程中不可以选择甲基橙为指示剂 离定至①处时,溶液中离子浓度关系为: c(A-)>c(Na+)>c(H+)>c(OH-) 由①到③过程中,水的电离程度先增大后减小
c1一定大于0.2 mol·L-1 HA的电离方程式是HA H.++A.- 甲反应后溶液中:c(Na+) > c(OH-) > c(A-) > c(H+) 乙反应后溶液中:c(Na+) < c(HA)+c(A-)
H.++A.- 甲反应后溶液中:c(Na+) > c(OH-) > c(A-) > c(H+) 乙反应后溶液中:c(Na+) < c(HA)+c(A-)
该一元酸溶液浓度为0.10 mol·L-1 a、b、c点的水溶液导电性依次增强 室温时,HA的电离常数Ka≈l×10-5 a点和c点所示溶液中H2O的电离程度相同
c1一定大于0.2 mol·L-1 HA的电离方程式是HA H+ +A.- 甲反应后溶液中:c(Na+) > c(OH-) > c(A-) > c(H+) 乙反应后溶液中:c(Na+) < c(HA) + c(A-) ks5u
H+ +A.- 甲反应后溶液中:c(Na+) > c(OH-) > c(A-) > c(H+) 乙反应后溶液中:c(Na+) < c(HA) + c(A-) ks5u

 该混合溶液中c(Aˉ)+c(Y)=c(Na+) 图中X.表示HA,Y.表示OH-,Z.表示H+
该混合溶液中c(Aˉ)+c(Y)=c(Na+) 图中X.表示HA,Y.表示OH-,Z.表示H+
 H.++A.- 甲反应后溶液中:c(Na+)>c(OH-)>c(A-)>c(H+) 乙反应后的溶液中:c(Na+)<c(HA)+c(A-)
H.++A.- 甲反应后溶液中:c(Na+)>c(OH-)>c(A-)>c(H+) 乙反应后的溶液中:c(Na+)<c(HA)+c(A-)
 不考虑其他组的实验结果,
不考虑其他组的实验结果, ③组实验中,混合溶液中
③组实验中,混合溶液中 ①组实验中,混合溶液中
①组实验中,混合溶液中
 乙反应后的溶液中:c(Na+) < c(HA) + c(A-)
乙反应后的溶液中:c(Na+) < c(HA) + c(A-)
 H.++A.- 甲反应后溶液中:c(Na+) > c(OH-) > c(A-) > c(H+) 乙反应后溶液中:c(Na+) < c(HA)+c(A-)
H.++A.- 甲反应后溶液中:c(Na+) > c(OH-) > c(A-) > c(H+) 乙反应后溶液中:c(Na+) < c(HA)+c(A-)
 H+ +A.- 甲反应后溶液中:c(Na+) > c(OH-) > c(A-) > c(H+) 乙反应后溶液中:c(Na+) < c(HA) + c(A-) ks5u
H+ +A.- 甲反应后溶液中:c(Na+) > c(OH-) > c(A-) > c(H+) 乙反应后溶液中:c(Na+) < c(HA) + c(A-) ks5u