你可能感兴趣的试题
代表阿伏加德罗常数,下列说法不正确的是 ( ) A.阿伏加德罗常数N.A.是0.012kg12 C.中所含的原子数 2g氢气所含氢原子数目为N.A 标况下,22.4L NH3所含的分子数目为N.A. 1L. 1 mo1·L-1 NaCl溶液中所含有的Na+离子数目为N.A.
阿伏加德罗常数是12 g 14C中所含的碳原子数 阿伏加德罗常数是 0.012 kg 12C中所含的质子数 阿伏加德罗常数是6.02×1023 mol-1 阿伏加德罗常数的符号为NA,近似值为6.02×1023 mol-1
1mol氖气中含有的原子数目为NA 5.85 g NaCl中含有的最外层电子数目为1.6NA 2 mol NO和1 mol O2混合,充分反应后转移的电子数目为4NA 25℃时,1L0. 1 mo1• L-1 Na2S溶液中的阴离子数目小于0.1 NA
阿伏加德罗常数是12g碳中所含的碳原子数 阿伏加德罗常数是 0.012kg12 中所含的原子数 C.阿伏加德罗常数是6.02×1023 mol-1 阿伏加德罗常数的符号为NA,近似值为6.02×1023 mol-1
阿伏加德罗常数NA是0.012kg12 C中所含的原子数 2g氢气所含氢原子数目为NA 标况下,22.4L NH3所含的分子数目为NA 1 L 1 mo1·L-1 NaCl溶液中所含有的Na+离子数目为NA
6.02×1023就是阿伏加德罗常数 0.012 kg 12含有的碳原子数就是阿伏加德罗常数的值 C. 含有阿伏加德罗常数个粒子的物质的量是1 mol 1 mol NH3所含原子数约是2.408×1024
6.02×1023就是阿伏加德罗常数 0.012 kg 12含有的碳原子数就是阿伏加德罗常数的值 C.含有阿伏加德罗常数个粒子的物质的量是1 mol 1 mol NH3所含原子数约是2.408×1024
1 mol任何粒子的粒子数叫阿伏加德罗常数,12g 12C含有阿伏加德罗常数个碳原子 1 mol硫酸在水溶液中电离出的离子数约为2NA 硫酸根离子的摩尔质量是96 g·mol-1 同温同压下,相同体积的任何气体含有相同数目的分子
在常温、常压下,11.2LN.2含有的分子数为0.5NA 在常温、常压下1mol氖气含有的原子数为N.A 7.8g Na2O.2与足量水反应时,转移的电子数目为0.2NA 2.7g金属铝变为Al3+时得到的电子数目为0.3NA
16g氧气中所含的氧原子数为NA 18g水所含电子数为10NA NA个氧气分子和NA个氢气分子的质量比为16∶1 常温常压下,11.2LCl2含有的分子数为0.5NA
常温常压下,11.2L氧气所含有的原子数目为NA 9g水所含有的电子数目为0.5NA 1mol氢分子含有的电子数目为NA 0.1molCH4含有的质子数目为NA
0.012kg13C.中碳原子数为N.A 与S.反应时,0.1molCu失去电子数为0.1NA 常温常压下,0.5摩尔CO2分子质量为22g 7.8gNa2O.2与足量CO2充分反应,转移电子为0.1NA
16g氧气中所含的氧原子数为NA 18g水所含电子数为10NA NA个氧气分子和NA个氢气分子的质量比为16∶1 常温常压下,11.2LCl2含有的分子数为0.5NA
64 g氧气中含氧分子数为2NA 1.7 g OH-中所含的电子数为NA 49 g硫酸中所含氧原子数为2NA 58.5 g氯化钠中所含的离子数为NA
常温常压下,7g NH3所含的电子数为0.8Na 标准状况下,11.2L. S03所含的氧原子数为 5Na 1mol Si02中含有Si—O键的数目为2Na 1mol Fe与足量的稀硝酸反应,转移的电子总数为3Na
阿伏加德罗常数NA的数值是0.012kg12 C. 中所含的原子数 标准状况下,22.4LCl2与过量Fe反应时转移电子数目为2NA 标况下,22.4L SO2所含的分子数目约为NA 标准状况下,5.6L. NO和5.6L. O2混合后的分子总数为0.5 NA
1 mol NH3所含有的原子数为NA 常温常压下,22.4L氧气所含的原子数为2NA 常温常压下,48gO2和O3的混和物中所含氧原子数为3NA 1L. 0.1 mol/LNaCl溶液中所含的Na+为NA
6.02×1023就是阿伏加德罗常数 12 g 12C含有的碳原子数就是阿伏加德罗常数 阿伏加德罗常数个粒子的物质的量是1 mol 1 mol NH3所含的原子数约是2.408×1024
常温常压下,8 g O2含有4nA个电子 1 L 0.1 mol·L-1的氨水中有nA个NH 标准状况下,22.4L.盐酸含有nA个HCl分子 1 mol Na被完全氧化生成Na2O2,失去了2nA电子
标准状况下,22.4L.盐酸含有nA个HCl分子 1 mol Na被完全氧化生成Na2O2,失去了2nA电子
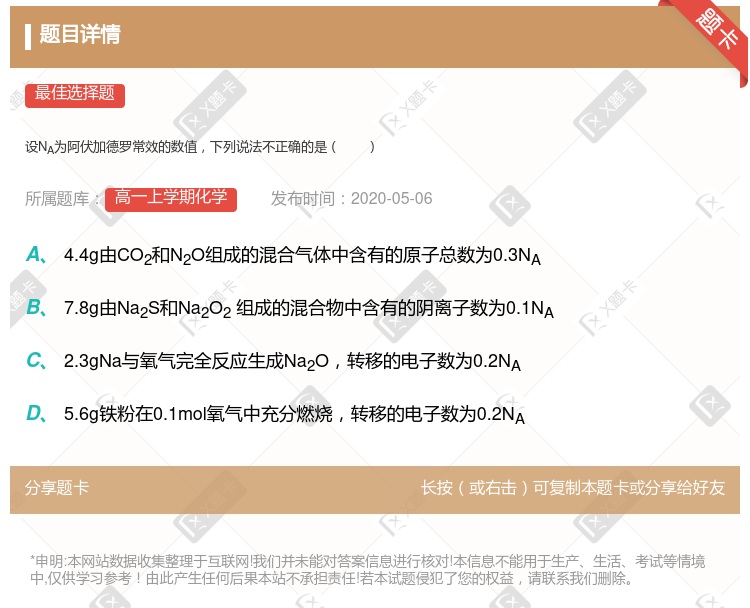
 标准状况下,22.4L.盐酸含有nA个HCl分子 1 mol Na被完全氧化生成Na2O2,失去了2nA电子
标准状况下,22.4L.盐酸含有nA个HCl分子 1 mol Na被完全氧化生成Na2O2,失去了2nA电子