你可能感兴趣的试题
OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生氢气 原混合酸中SO42-物质的量为0.6 mol 第二份溶液中最终溶质为FeSO4 取20mL原混合酸加水稀释至1L后溶液的c(H+)=0.2mol/L
原混合酸中NO 物质的量为0.1 mol OA段产生的是NO,AB段的反应为Fe+2Fe3+===3Fe2+, BC段产生氢气 第二份溶液中最终溶质为FeSO4 H2SO4浓度为0.25 mol·L-1
物质的量为0.1 mol OA段产生的是NO,AB段的反应为Fe+2Fe3+===3Fe2+, BC段产生氢气 第二份溶液中最终溶质为FeSO4 H2SO4浓度为0.25 mol·L-1
H2SO4浓度为2.5 mol·L-1 OA段产生的是NO,AB段的反应为Fe+2Fe3+===3Fe2+,BC段产生氢气 第二份溶液中最终溶质为FeSO4 原混合酸中NO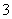 物质的量为0.1 mol
物质的量为0.1 mol
原200mL混合酸中NO3-物质的量为0.1mol OA段产生的是NO,AB段的反应为Fe+2Fe3+==3Fe2+,BC段产生氢气 第二份溶液中最终溶质为FeSO4 H2SO4浓度为2.5mol/L
AB段的反应为Fe+2Fe3+===3Fe2+ 第二份溶液中最终溶质为FeSO4 混合酸中NO 物质的量为0.4 mol 混合酸中H2SO4浓度为5 mol·L-1
物质的量为0.4 mol 混合酸中H2SO4浓度为5 mol·L-1
H2SO4浓度为2.5 mol·L-1 OA段产生的是NO,AB段的反应为Fe+2Fe3+===3Fe2+,BC段产生氢气 第二份溶液中最终溶质为FeSO4 原混合酸中NO3-物质的量为0.1 mol
原混合酸中NO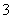 物质的量为0.1 mol OA段产生的是NO,AB段的反应为Fe+2Fe3+===3Fe2+, BC段产生氢气 第二份溶液中最终溶质为FeSO4 H2SO4浓度为2.5 mol·L-1
物质的量为0.1 mol OA段产生的是NO,AB段的反应为Fe+2Fe3+===3Fe2+, BC段产生氢气 第二份溶液中最终溶质为FeSO4 H2SO4浓度为2.5 mol·L-1
原混合酸中NO3-物质的量为0.4 mol 原混合酸中H2SO4浓度为2.0 mol·L-1 第二份溶液中最终溶质为FeSO4 OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生氢气
12.8 g 19.2 g 32.0 g 38.4 g
原混合酸中NO3-物质的量为0.4 mol 原混合酸中H2SO4浓度为2.0 mol·L-1 第二份溶液中最终溶质为FeSO4 OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生氢气
混合酸中H2SO4浓度为4 mol·L-1 200mL混合酸中NO3-物质的量为0.2mol AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生氢气 加入铜粉的那份混合酸,反应后剩余0.1mol H2SO4
原混合酸中NO3- 物质的量为0.1 mol OA段产生的是NO,AB段的反应为Fe + 2Fe3+ = 3Fe2+, BC段产生氢气 第二份溶液中最终溶质为FeSO4 H2SO4 浓度为2.5 mol·L-1
原200mL混合酸中NO3-物质的量为0.1mol OA段产生的是NO,AB段的反应为Fe+2Fe3+==3Fe2+,BC段产生氢气 第二份溶液中最终溶质为FeSO4 H2SO4浓度为2.5mol/L
H2SO4浓度为4 mol·L-1 OA段产生的是NO,AB段的反应为 Fe+2Fe3+=3Fe2+,BC段产生氢气 第二份溶液中最终溶质为FeSO4 混合酸中NO3-物质的量为0.2mol
图中,AB段的反应为Fe+2Fe 3+=3Fe 2+,溶液中溶质最终为FeSO 4 原溶液中H 2SO 4浓度为2.5mol·L -1 原混合溶液中NO3-的物质的量为0.4mol 图中,OA段产生的气体是NO,BC段产生的气体是氢气
H2SO4浓度为2.5 mol·L-1 OA段产生的是NO,AB段的反应为Fe+2Fe3+===3Fe2+,BC段产生氢气 第二份溶液中最终溶质为FeSO4 原混合酸中NO 物质的量为0.1 mol
物质的量为0.1 mol
原混合液中NO3-的物质的量为0.2mol OA段产生是NO,AB段反应为2Fe3++Fe = 3Fe2+,BC段产生氢气 溶液中最终溶质为FeSO4 c(H2SO4)为5mol·L-1

 物质的量为0.1 mol OA段产生的是NO,AB段的反应为Fe+2Fe3+===3Fe2+, BC段产生氢气 第二份溶液中最终溶质为FeSO4 H2SO4浓度为0.25 mol·L-1
物质的量为0.1 mol OA段产生的是NO,AB段的反应为Fe+2Fe3+===3Fe2+, BC段产生氢气 第二份溶液中最终溶质为FeSO4 H2SO4浓度为0.25 mol·L-1
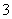 物质的量为0.1 mol
物质的量为0.1 mol
 物质的量为0.4 mol 混合酸中H2SO4浓度为5 mol·L-1
物质的量为0.4 mol 混合酸中H2SO4浓度为5 mol·L-1
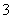 物质的量为0.1 mol OA段产生的是NO,AB段的反应为Fe+2Fe3+===3Fe2+, BC段产生氢气 第二份溶液中最终溶质为FeSO4 H2SO4浓度为2.5 mol·L-1
物质的量为0.1 mol OA段产生的是NO,AB段的反应为Fe+2Fe3+===3Fe2+, BC段产生氢气 第二份溶液中最终溶质为FeSO4 H2SO4浓度为2.5 mol·L-1

 物质的量为0.1 mol
物质的量为0.1 mol