你可能感兴趣的试题
CrO3+NH3+H2O Cr2O3+NH3+H2O CrO3+N2+H2O Cr2O3+N2+H2O
消耗硫酸亚铁铵的物质量为n(2-x)mol 处理废水中Cr2O72- 的物质的量为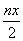 mol 反应中发生转移的电子数为3nx mol 在FeO·FeyCrxO3中3x=y
mol 反应中发生转移的电子数为3nx mol 在FeO·FeyCrxO3中3x=y
消耗硫酸亚铁铵的物质量为n(2-x)mol 处理废水中Cr2O72- 的物质的量为(nx)/2 mol 反应中发生转移的电子数为3nx mol 在FeO·FeyCrxO3中3x=y
在FeO·FeyCrxO3中3x=y 反应中发生转移的电子的物质的量为3nx mol 处理废水中Cr2O72- 的物质的量为 mol 消耗硫酸亚铁铵的物质的量为n(2—x)mol
mol 消耗硫酸亚铁铵的物质的量为n(2—x)mol
CrO3 + NH3 + H2O Cr2O3 +NH3 + H2O CrO3 + N2 + H2O Cr2O3 +N2+ H2O
污水中的Cr3+在溶解的氧气的作用下可被氧化为Cr2O72— K2Cr2O7可以氧化乙醇,该反应可用于检查酒后驾驶 在反应Cr2O72—+I一+H+→Cr3++I2 +H2O中,氧化产物与还原产物的物质的量之比为3:2 发生铬中毒时,可服用维生素C.缓解毒性,因为维生素C.具有还原性
反应⑴和⑵均为氧化还原反应 反应⑴的氧化剂是O.2,还原剂是FeO·Cr2O.3 高温下,O.2的氧化性大于Fe2O.3小于Na2CrO4 生成1mol的Na2Cr2O.7时共转移7mol电子
有l/2摩+6价的S.被还原 有1/3摩一3价的N.被氧化 有2/3摩(NH4)2SO4分解 有3/4摩SO2生成
消耗硫酸亚铁铵的物质量为n(2-x)mol 处理废水中Cr2O72- 的物质量为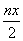 mol 反应中发生转移的电子数为3nx mol 在FeO·FeyCrxO3中3x=y
mol 反应中发生转移的电子数为3nx mol 在FeO·FeyCrxO3中3x=y
反应(1)和(2)均为氧化还原反应 反应(1)的氧化剂是O2,还原剂是FeO·Cr2O3 高温下,O2的氧化性强于Fe2O3,弱于Na2CrO4 反应(1)中每生成1molNa2CrO4时电子转移3mol
Cr、NH3、H2O Cr2O3、N2、H2O Cr2O3、NH3、H2O CrO3、N2、H2O
消耗硫酸亚铁的物质的量为n(2-x) 处理废水中的Cr2O72-的物质的量为nx/2 反应中发生转移的电子数为3nxmol 在FeO·FeyCrxO3中,3x=y

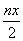 mol 反应中发生转移的电子数为3nx mol 在FeO·FeyCrxO3中3x=y
mol 反应中发生转移的电子数为3nx mol 在FeO·FeyCrxO3中3x=y
 mol 消耗硫酸亚铁铵的物质的量为n(2—x)mol
mol 消耗硫酸亚铁铵的物质的量为n(2—x)mol
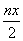 mol 反应中发生转移的电子数为3nx mol 在FeO·FeyCrxO3中3x=y
mol 反应中发生转移的电子数为3nx mol 在FeO·FeyCrxO3中3x=y