你可能感兴趣的试题
ABn型分子中,若中心原子没有孤对电子,则ABn为空间对称结构,属于非极性分子 水很稳定是因为水中含有大量的氢键所致 H2O、NH3、CH4分子中的O、N、C分别形成2个、3个、4个σ键,故O、N、C原子分别采取sp1、sp2、sp3 杂化 配合物[Cu(H2O)4]SO4中,中心离子是Cu2+,配位体是SO42-,配位数是1
原子可以构成分子,也可以直接构成物质 原子通过得失电子形成离子,但离子不能变成原子 在化学反应中,原子的核外电子经常充当重要的角色 某原子中含有36个质子,则该原子核外含有36个电子
离子晶体一定含有离子键,分子晶体一定含有共价键 某晶体中若含有阳离子,则一定含有阴离子 同一主族元素的氢化物,相对分子质量越大,它的沸点一定越高 同一周期元素的原子,半径越小,越容易得到电子
含有阴离子的晶体中一定含有阳离子,含有阳离子的晶体中一定含有阴离子。 两种不同的酸混合时,溶液可能呈酸性,也可能呈中性。 失电子难的原子,其得电子一定容易;得电子难的原子,其失电子一定容易。 极性分子一定含有极性键,非极性分子一定含有非极性键
元素的第一电离能(I1)是元素的单质失去最外层1个电子所需要吸收的能量,同周期从左到右元素的I1逐渐增大。 元素的电负性是衡量元素在化合物中吸引电子能力大小的一种标度,同主族从上到下元素的电负性逐渐减小。 含有阴离子的晶体中一定含有阳离子,含有阳离子的晶体中不一定含有阴离子。 原子晶体中一定含有共价键;离子晶体中一定含有离子键,可能含有共价键;分子晶体中一定存在分子间作用力。
所有原子都在同一平面内
分子中不含有氢原子
在ABn型分子中A原子最外层电子均已成键(无孤对电子)
A的相对原子质量均小于B
所有原子在同一平面 分子中不含有氢原子 在ABn中A.原子没有孤对电子 A.的相对原子质量小于B.
Lewis酸 lewis碱 富有电子的物质 往往含有孤对电子对
只要含有金属阳离子的晶体就一定是离子晶体 离子晶体中一定含金属阳离子 在共价化合物分子中各原子都形成8电子结构 分子晶体的熔点不一定比金属晶体熔点低
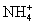 CH4 H2S SiH4
CH4 H2S SiH4
两种元素组成的分子中一定只有极性键 分子中的价电子对(包括成键电子对和孤电子对)之间存在相互排斥作用 非金属元素组成的化合物一定是共价化合物 含有阳离子的物质一定含有阴离子
原子是由分子构成的。 原子中含有质子、中子和核外电子。 原子若失去核外电子,则会变成阴离子。 原子若得到核外电子,则会变成阳离子。
根据对角线规则,铍和铝的性质具有相似性 2+中Cu提供空轨道,H2O中O提供孤对电子形成配位键 元素电负性越大的原子,吸引电子的能力越强 手性分子互为镜像,它们的性质没有区别

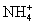 CH4 H2S SiH4
CH4 H2S SiH4