
 Na+的结构示意图:
Na+的结构示意图: Na的电子排布式:1s22s22p63s1 Na的外围电子排布式:3s1
Na的电子排布式:1s22s22p63s1 Na的外围电子排布式:3s1
 Na+的结构示意图:
Na+的结构示意图: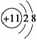 Na的电子排布式:1s22s22p63s1 Na的简化电子排布式:[Ne]3s1
Na的电子排布式:1s22s22p63s1 Na的简化电子排布式:[Ne]3s1
 Na+的结构示意图:
Na+的结构示意图: Na的电子排布式:1s22s22p63s1 Na的简化电子排布式:[Ne]3s1
Na的电子排布式:1s22s22p63s1 Na的简化电子排布式:[Ne]3s1
 CO2的结构式:O=C=O 二氧化硅的分子式:SiO2 乙烯的结构简式为CH2=CH2
CO2的结构式:O=C=O 二氧化硅的分子式:SiO2 乙烯的结构简式为CH2=CH2