你可能感兴趣的试题
2H2(g)+O2(g) == 2H2O(1) △H.= —285.8kJ/mol 2H2(g)+ O2(g) == 2H2O(1) △H.= +571.6 kJ/mol 2H2(g)+O2(g) == 2H2O(g) △H.= —571.6 kJ/mol H2(g)+ 1∕2O2(g) == H2O(1) △H.= —285.8kJ/mol
2H2(g)+ O2(g) == 2H2O(1) △H.= +571.6 kJ/mol 2H2(g)+O2(g) == 2H2O(g) △H.= —571.6 kJ/mol H2(g)+ 1∕2O2(g) == H2O(1) △H.= —285.8kJ/mol
2H2(g)+O2(g) == 2H2O(1) △H.= -285.8 kJ/mol 2H2(g)+ O2(g) == 2H2O(1) △H.= +571.6 kJ/mol 2H2(g)+O2(g) == 2H2O(g) △H.= -571.6 kJ/mol H2(g)+
2H2(g)+ O2(g) == 2H2O(1) △H.= +571.6 kJ/mol 2H2(g)+O2(g) == 2H2O(g) △H.= -571.6 kJ/mol H2(g)+ O2(g) == H2O(1) △H.= -285.8 kJ/mol
O2(g) == H2O(1) △H.= -285.8 kJ/mol
2H2(g)+O2(g)=2H2O (l) △H=-285.8 kJ·mol-1 2H2(g)+O2(g)=2H2O (l) △H=+571.6 kJ·mol-1 2H2(g)+O2(g)=2H2O (g) △H=-571.6 kJ·mol-1 H2(g)+1/2O2(g)=H2O (l) △H=-285.8 kJ·mol-1
该反应的反应热为△H = —571.6kJ/mol ,是放热反应 该反应的△H与各物质的状态有关,与化学计量数也有关 该式的含义为:25℃、101kPa下,2mol氢气完全燃烧生成液态水时放出热量571.6kJ 该反应为氢气燃烧的热化学方程式,由此可知氢气的燃烧热为571.6kJ/mol
由“C(石)→C.(金);△H= +1.9 kJ/mol ”可知金刚石比石墨稳定 在101KPa时,1mol碳燃烧所放出的热量为碳的燃烧热 在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g) = 2H2O(l);△H= -571.6kJ/mol HCl和NaOH反应的中和热△H= -57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热为 △H= -(2×57.3)kJ/mol
该反应的反应热为△H = —571.6kJ/mol ,是放热反应 该反应的△H.与各物质的状态有关,与化学计量数也有关 该式的含义为:25℃、101kPa下,2mol氢气完全燃烧生成液态水时放出热量571.6kJ 该反应为氢气燃烧的热化学方程式,由此可知氢气的燃烧热为571.6kJ/mol
等物质的量的硫蒸气和硫粉分别完全燃烧,后者放出热量多 由 (石墨)→C(金刚石) ΔH.=+11.9kJ·mol-1 可知,金刚石比石墨稳定 C.在25℃,101kPa时,2g氢气完全燃烧生成液态水,放出285.8kJ热量,则氢气燃烧的热化学方程式可表示为:2H2(g)+O2(g)=2H2O(l) ΔH.=-571.6kJ·mol-1 H.+(aq)+OH-(aq)= H2O(l) ΔH.=-57.3kJ·mol-1,若将含0.5molH2SO4的浓硫酸与含1molNaOH的氢氧化钠溶液混合,放出的热量等于57.3kJ
2H2(g) + O2(g) == 2H2O(1) △H.= ―285.8kJ/mol 2H2(g) + O2(g) == 2H2O(1) △H.= +571.6 kJ/mol 2H2(g) + O2(g) == 2H2O(g) △H.= ―571.6 kJ/mol H2(g) + 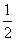 O2(g) == H2O(1) △H.= ―285.8kJ/mol
O2(g) == H2O(1) △H.= ―285.8kJ/mol

 2H2(g)+ O2(g) == 2H2O(1) △H.= +571.6 kJ/mol 2H2(g)+O2(g) == 2H2O(g) △H.= —571.6 kJ/mol H2(g)+ 1∕2O2(g) == H2O(1) △H.= —285.8kJ/mol
2H2(g)+ O2(g) == 2H2O(1) △H.= +571.6 kJ/mol 2H2(g)+O2(g) == 2H2O(g) △H.= —571.6 kJ/mol H2(g)+ 1∕2O2(g) == H2O(1) △H.= —285.8kJ/mol
 2H2(g)+ O2(g) == 2H2O(1) △H.= +571.6 kJ/mol 2H2(g)+O2(g) == 2H2O(g) △H.= -571.6 kJ/mol H2(g)+
2H2(g)+ O2(g) == 2H2O(1) △H.= +571.6 kJ/mol 2H2(g)+O2(g) == 2H2O(g) △H.= -571.6 kJ/mol H2(g)+ O2(g) == H2O(1) △H.= -285.8 kJ/mol
O2(g) == H2O(1) △H.= -285.8 kJ/mol
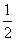 O2(g) == H2O(1) △H.= ―285.8kJ/mol
O2(g) == H2O(1) △H.= ―285.8kJ/mol