你可能感兴趣的试题
平衡常数K. 电离常数Ka 水的离子积常数 盐的水解常数
电离平衡常数能衡量电解质电离的相对强弱 电离平衡常数不随浓度变化而变化 电离平衡常数与温度有关 电离平衡常数不随任何条件而改变
电离平衡常数越小,表示弱电解质的电离能力越弱 电离平衡常数与温度无关 不同浓度的同一弱电解质,其电离平衡常数不同 多元弱酸各步电离平衡常数相互关系为:K1〈K2〈K3
四种平衡常数都是一个比值,没有单位 四种平衡常数都是温度的函数,温度升高其值都增大 一个化学反应的平衡常数与物质的计量数无关 对于同类型反应,化学平衡常数K.的大小反映了化学反应可能进行的程度
因为水的离子积常数的表达式是K.w=c(H+)·c(OH-),所以K.w随溶液中H.+和OH-浓度的变化而变化 水的离子积常数K.w与水的电离平衡常数K.电离是同一个物理量 水的离子积常数仅仅是温度的函数,随着温度的变化而变化 水的离子积常数K.w与水的电离平衡常数K.电离是两个没有任何关系的物理量
化学反应速率v 化学平衡常数K. 水的离子积常数Kw 弱酸的电离常数Ka
CH3COONa NaClO Na2CO3 Na3PO4
某亚硫酸溶液pH=4.3,若忽略二级电离,则其一级电离平衡常数K1=1.0×10-8.60 mol2·L-2 Ka(HCN)Ksp(AgI)Ksp(AgCl)
一定温度下,弱酸的电离常数越大,酸性越强 醋酸的电离常数Ka和醋酸钠的水解常数Kh之间的关系为:Ka·Kh=Kw 溶度积越小,该物质一般越容易在溶液中形成沉淀 合成氨的反应,正反应的平衡常数和逆反应的平衡常数相同。
电离平衡常数能衡量电解质电离的相对强弱 电离平衡常数不随浓度变化而变化 电离平衡常数与温度有关 电离平衡常数不随任何条件而改变
K.、K.a或K.b、K.h、K.sp、K.w都与温度有关,温度越高,常数值越大 比较K.sp与离子积Q.c的相对大小,可判断难溶解电解质在给定条件下沉淀能否生成或溶解 K.值越大,正反应进行的程度越大,一般地说,K.>105时,该反应进行得就基本完全了 弱酸HA的K.a与NaA的K.h、水的离子积常数K.w三者间的关系可表示为:K.w=K.a·K.h
电离平衡常数(K.)与温度无关 H2CO3的电离常数表达式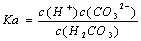 同温下,电离平衡常数越小表示弱电解质电离能力越弱 多元弱酸各步电离平衡常数相互关系为:K123
同温下,电离平衡常数越小表示弱电解质电离能力越弱 多元弱酸各步电离平衡常数相互关系为:K123
碳酸的酸性强于氢硫酸 多元弱酸的酸性主要由第一步电离决定 多元弱酸的各步电离之间无影响 向弱酸溶液中加少量NaOH固体,电离常数不变
各平衡常数的大小与温度有关 若温度升高则各平衡常数一定增大 平衡常数的大小能说明反应(或电离、溶解)进行的程度 平衡常数越大反应(或电离、溶解)程度越大
不同浓度的同一弱电解质,其电离平衡常数(K.)不同 电离平衡常数(K.)越小,表示弱电解质电离能力越弱 多元弱酸各步电离平衡常数相互关系为:K.1<K.2<K.3 CH3COOH溶液中加入少量CH3COONa溶液,电离常数减小
电离平衡常数能衡量电解质电离的相对强弱 电离平衡常数不随浓度的变化而变化 电离平衡常数与温度有关 电离平衡常数不随任何条件而改变
电离度越大,电离平衡常数越大; 浓度越稀,电离度越大,电离平衡常数越大; 在相同的温度下电离度可变,而电离平衡常数不变; 多元弱酸的每一步电离平衡常数是相同的

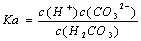 同温下,电离平衡常数越小表示弱电解质电离能力越弱 多元弱酸各步电离平衡常数相互关系为:K1
同温下,电离平衡常数越小表示弱电解质电离能力越弱 多元弱酸各步电离平衡常数相互关系为:K1