你可能感兴趣的试题
25 ℃时,0.1 mol·L-1 HF溶液中pH=1 K.sp(CaF2)随温度和浓度的变化而变化 该体系中没有沉淀产生 该体系中HF与CaCl2反应产生沉淀
0.1mol/LpH为4的NaHB溶液中:c(HB-)>c(H2 )>c(B2-) B. 左图表示25℃时,用0.1mol·L-1盐酸滴定20mL0.1mol·L-1NaOH溶液,溶液的pH随加入酸体积的变化 在pH=2的NaHSO4溶液中c(H+)=c(OH-)+ c(SO42-) pH=2的两种一元酸x和y,体积均为100 mL,稀释过程中pH与溶液体积的关系如图所示,分别滴加NaOH溶液(c=0.1mol·L-1)至pH=3,消耗NaOH溶液的体积为Vx、Vy,则x为强酸,y为弱酸且Vx>Vy
AgCl不能转化为AgI 25℃时,0.1mol/L HF溶液pH=l 向1L0.1 mol/LHF溶液中加入1L 0.1 mol/LCaCl2溶液,没有沉淀产生 25℃时,使AgCl转化为AgI,则加入KI溶液的浓度不低于5×10﹣12 mol/L
M点溶液中水的电离程度比原溶液大 在M.点时,n(OH-)-n(H+)=(a -0.05)mol 随着NaOH的加入,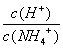 不断增大 当n(NaOH)=0.05mol时溶液中有: c(Cl-)>c(Na+)>c(NH4+)>c(OH-)>c(H+)
不断增大 当n(NaOH)=0.05mol时溶液中有: c(Cl-)>c(Na+)>c(NH4+)>c(OH-)>c(H+)
M.点溶液中水的电离程度比原溶液小 在M.点时,n(OH-)-n(H+)=(a-0.05)mol 随着NaOH的加入,
在M.点时,n(OH-)-n(H+)=(a-0.05)mol 随着NaOH的加入,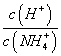 不断减小 当n(NaOH)=0.1mol时, c(OH-)>c(Cl-)>c(NH3·H2O)
不断减小 当n(NaOH)=0.1mol时, c(OH-)>c(Cl-)>c(NH3·H2O)
向1L浓度均为0.1mol·L-1的Ba(OH)2、NaAlO2混合液中逐滴加入0.1 mol·L-1稀H2SO4溶液 向含有0.1 mol·L-1 AlCl3和0.3mol/L NH4Cl的1L混合液中逐滴加入0.1 mol·L-1NaOH溶液 向烧碱溶液中逐滴加入明矾溶液 向Ba(OH)2溶液中逐渐通入二氧化碳气体
加入水时,平衡向正反应方向移动,溶液中n(H+)增大 加入少量冰醋酸,平衡向正反应方向移动,溶液中c(H+)增大 加入少量0.1 mol·L-HCl溶液,平衡向逆反应方向移动,溶液中c(H+)减小 加入少量CH3COONa固体,平衡向逆反应方向移动,溶液中c(H+)减小
氢氟酸的电离过程是吸热的 当V=20时,溶液中:c(F-)<c(Na+)=0.1mol•L-1 当V.<20时,溶液中离子浓度关系可能为:c(Na+)=c(F-) 当V.>20时,溶液中离子浓度关系一定为:c(Na+)>c(F-)>c(OH-)>c(H+)
3mol.L-1 2.5mol.L-1 2mol.L-1 1.5mol.L-1
a/4v mol/L 3y+x/v mol/L a/3v mol/L 无法计算
未加盐酸时:c(OH-)>c(Na+)=c(NH3·H2O) 加入10 mL盐酸时:c(N )+c(H+)=c(OH-) 加入盐酸至溶液pH=7时:c(Cl-)=c(Na+) 加入20 mL盐酸时:c(Cl-)=c(NH4+)+c(Na+)
)+c(H+)=c(OH-) 加入盐酸至溶液pH=7时:c(Cl-)=c(Na+) 加入20 mL盐酸时:c(Cl-)=c(NH4+)+c(Na+)
X.与Y.的差值为0.01 mol 原溶液中c(Cl-)=0.66mol·L-1 原溶液的c(H+)=0.8 mol·L-1 原溶液中n(Mg2+)∶n(Al3+)=10∶1
在M.点时,n(OH-)-n(H+)=(a-0.05) mol 随着NaOH的加入, 不断增大 M.点溶液中水的电离程度比原溶液小 当n(NaOH)=0.1 mol时,c(OH-)>c(Cl-)-c(NH3·H2O)
不断增大 M.点溶液中水的电离程度比原溶液小 当n(NaOH)=0.1 mol时,c(OH-)>c(Cl-)-c(NH3·H2O)
a表示Fe3+的关系曲线 n1=0.75 P.点时,n(Fe2+)=0.5625 mol 向P.点溶液中加入铜粉,最多可溶解14.4 g
4种溶液pH的大小顺序:①>④>③>② 溶液①、②等体积混合后pH > 7,则c(NH4+) < c(NH3·H2O) 向溶液③、④中分别加入12.5 mL 0.1 mol·L-1 NaOH溶液后,两溶液中的离子种类相同 向溶液①、②中分别加入25 mL 0.1 mol·L-1 盐酸后,溶液中c(NH4+):①>②
氢氟酸的电离过程是吸热的 当V=20时,溶液中:c(F-)<c(Na+)=0.1mol•L-1 当V.<20时,溶液中离子浓度关系可能为:c(Na+)=c(F-) 当V.>20时,溶液中离子浓度关系一定为:c(Na+)>c(F-)>c(OH-)>c(H+)

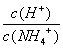 不断增大 当n(NaOH)=0.05mol时溶液中有: c(Cl-)>c(Na+)>c(NH4+)>c(OH-)>c(H+)
不断增大 当n(NaOH)=0.05mol时溶液中有: c(Cl-)>c(Na+)>c(NH4+)>c(OH-)>c(H+)
 在M.点时,n(OH-)-n(H+)=(a-0.05)mol 随着NaOH的加入,
在M.点时,n(OH-)-n(H+)=(a-0.05)mol 随着NaOH的加入,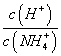 不断减小 当n(NaOH)=0.1mol时, c(OH-)>c(Cl-)>c(NH3·H2O)
不断减小 当n(NaOH)=0.1mol时, c(OH-)>c(Cl-)>c(NH3·H2O)
 mol/L
mol/L  mol/L
mol/L  mol/L 无法计算
mol/L 无法计算
 )+c(H+)=c(OH-) 加入盐酸至溶液pH=7时:c(Cl-)=c(Na+) 加入20 mL盐酸时:c(Cl-)=c(NH4+)+c(Na+)
)+c(H+)=c(OH-) 加入盐酸至溶液pH=7时:c(Cl-)=c(Na+) 加入20 mL盐酸时:c(Cl-)=c(NH4+)+c(Na+)
 不断增大 M.点溶液中水的电离程度比原溶液小 当n(NaOH)=0.1 mol时,c(OH-)>c(Cl-)-c(NH3·H2O)
不断增大 M.点溶液中水的电离程度比原溶液小 当n(NaOH)=0.1 mol时,c(OH-)>c(Cl-)-c(NH3·H2O)
 mol/L
mol/L  mol/L
mol/L  mol/L 无法计算
mol/L 无法计算