你可能感兴趣的试题
当氢氟酸溶液温度升高,HF的电离程度减小(不考虑挥发) 水电离的热化学方程式为:H2O(1)  H+(aq)+OH—(aq);△H.= +57.3kJ/mol 当c > 0.1时,一定不存在:c(Na+) = c(F—) 若混合后溶液中:c(Na+)>c(OH—) >c(F—)>c(H+),则c一定小于0.1
H+(aq)+OH—(aq);△H.= +57.3kJ/mol 当c > 0.1时,一定不存在:c(Na+) = c(F—) 若混合后溶液中:c(Na+)>c(OH—) >c(F—)>c(H+),则c一定小于0.1
pH=3时,溶液中:c(Na+)<c(F一) c(F一)>c(HF)时,溶液一定呈碱性 pH=4时,溶液中:c(HF)+c(Na+)+c(H+)-c(OH-)<2amol·L-1 pH=3.45时,NaOH溶液恰好与HF完全反应
pH=3时,溶液中:c(Na+)<c(F一) c(F一)>c(HF)时,溶液一定呈碱性 pH=4时,溶液中:c(HF)+c(Na+)+c(H+)-c(OH-)<2amol·L-1 pH=3.45时,NaOH溶液恰好与HF完全反应
HF溶液与Zn反应放出H2 0.1mol/LNaF溶液的pH大于7 HF溶液与Na2CO3反应生成CO2 0.1mol/LHF溶液可使紫色石蕊变红
氢氟酸的电离方程式及热效应可表示为:HF(aq) F-(aq)+ H+(aq) ΔH=-10.4kJ·mol-1 当V=20时,溶液中:c(OH-)=c(HF)+c(H+) 当V=20时,溶液中:c(F-)+)=0.1mol·L-1 当V>0时,溶液中可能存在:c(Na+)>c(F-)>c(OH-)>c(H+)
F-(aq)+ H+(aq) ΔH=-10.4kJ·mol-1 当V=20时,溶液中:c(OH-)=c(HF)+c(H+) 当V=20时,溶液中:c(F-)+)=0.1mol·L-1 当V>0时,溶液中可能存在:c(Na+)>c(F-)>c(OH-)>c(H+)
pH=3时,溶液中:c(Na+)<c(F﹣) c(F﹣)>c(HF)时,溶液一定呈碱性 pH=3.45时,NaOH溶液恰好与HF完全反应 pH=4时,溶液中:c(HF)+c(Na+)+c(H+)﹣c(OH﹣)<2amol•L﹣1
当氢氟酸溶液温度升高,HF的电离程度减小(不考虑挥发) 水电离的热化学方程式为:H2O(1)  H+(aq)+OH—(aq);△H= +57.3kJ/mol 当c > 0.1时,一定不存在:c(Na+) = c(F—) 若混合后溶液中:c(Na+)>c(OH—) >c(F—)>c(H+),则c一定小于0.1
H+(aq)+OH—(aq);△H= +57.3kJ/mol 当c > 0.1时,一定不存在:c(Na+) = c(F—) 若混合后溶液中:c(Na+)>c(OH—) >c(F—)>c(H+),则c一定小于0.1
氢氟酸的电离过程是吸热的
当V=20时,溶液中:c(F﹣)<c(Na+)=0.1mol•L﹣1
当V<20时,溶液中离子浓度关系可能为:c(Na+)=c(F﹣)
当V>20时,溶液中离子浓度关系一定为:c(Na+)>c(F﹣)>c(OH﹣)>c(H+)
50mLO.2mol·L-1CH3COOH与50mLO.1mol·L-1NaOH 50mLO.1mol·L-1CH3COOH与50mLO.1mol·L-1NaOH 50mLO.1mol·L-1CH3COOH与50mLO.2mol·L-1NaOH 50mLO.2mol·L-1HCl与50mLO.1mol·L-1NH3H2O
氢氟酸的电离方程式及热效应可表示为: 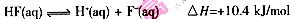 当V=20 mL时,溶液中:
当V=20 mL时,溶液中: 当V=20 mL时,溶液中:
当V=20 mL时,溶液中: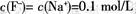 当v>0时,溶液中一定存在
当v>0时,溶液中一定存在
氢氟酸的电离方程式及热效应可表示为:HF(aq)=H+(aq) +F—(aq) △H.=+10.4 KJ·mol—1 当V.=20时,溶液中:c(OH—)=c(HF) +c(H+) 当V.=20时,溶液中:c(F—)<c(Na+)=0.1mol·L—1 当V.>0时,溶液中一定存在:c(Na+)>c(F—)>c(OH—)>c(H+)
氢氟酸的电离HF(aq)=H+(aq) +F—(aq)是吸热反应 当V.=20时,溶液中:c(OH—)=c(HF) +c(H+) 当V.=20时,溶液中:c(F—)<c(Na+)=0.1mol·L—1 当V.>0时,溶液中一定存在:c(Na+)>c(F—)>c(OH—)>c(H+)
氢氟酸的电离过程是吸热的 当V=20时,溶液中:c(F-)<c(Na+)=0.1mol•L-1 当V.<20时,溶液中离子浓度关系可能为:c(Na+)=c(F-) 当V.>20时,溶液中离子浓度关系一定为:c(Na+)>c(F-)>c(OH-)>c(H+)

 H+(aq)+OH—(aq);△H.= +57.3kJ/mol 当c > 0.1时,一定不存在:c(Na+) = c(F—) 若混合后溶液中:c(Na+)>c(OH—) >c(F—)>c(H+),则c一定小于0.1
H+(aq)+OH—(aq);△H.= +57.3kJ/mol 当c > 0.1时,一定不存在:c(Na+) = c(F—) 若混合后溶液中:c(Na+)>c(OH—) >c(F—)>c(H+),则c一定小于0.1
 F-(aq)+ H+(aq) ΔH=-10.4kJ·mol-1 当V=20时,溶液中:c(OH-)=c(HF)+c(H+) 当V=20时,溶液中:c(F-)
F-(aq)+ H+(aq) ΔH=-10.4kJ·mol-1 当V=20时,溶液中:c(OH-)=c(HF)+c(H+) 当V=20时,溶液中:c(F-) H+(aq)+OH—(aq);△H= +57.3kJ/mol 当c > 0.1时,一定不存在:c(Na+) = c(F—) 若混合后溶液中:c(Na+)>c(OH—) >c(F—)>c(H+),则c一定小于0.1
H+(aq)+OH—(aq);△H= +57.3kJ/mol 当c > 0.1时,一定不存在:c(Na+) = c(F—) 若混合后溶液中:c(Na+)>c(OH—) >c(F—)>c(H+),则c一定小于0.1
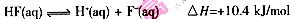 当V=20 mL时,溶液中:
当V=20 mL时,溶液中: 当V=20 mL时,溶液中:
当V=20 mL时,溶液中: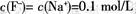 当v>0时,溶液中一定存在
当v>0时,溶液中一定存在