你可能感兴趣的试题
原电池工作一段时间后,FeCl2溶液中c(Cl-)会增大 此电池工作原理与硅太阳能电池工作原理相同 Fe为正极,石墨上发生的反应为:2H++2e-=H2↑ 若装置中的盐桥用铁丝代替,电流表指针无偏转 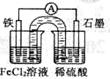
镁为负极 原电池中碳极的电极反应式为 电解池中阳极处先变红 电解池中阴极的电极反应式为
电解池中阳极处先变红 电解池中阴极的电极反应式为

该装置将电能转化为化学能 电子从电极X.转移到电极Y. X.为阳极,表面产生大量气泡 Y.为负极,电极反应为Zn-2e→Zn2+
原电池是化学能转变为电能的装置 构成原电池的正极和负极必须是两种不同的金属 原电池工作时,溶液中的阳离子向负极移动 原电池放电时,电流的方向是从负极到正极
该装置能形成原电池,其中铝是负极 该装置能形成原电池,其中铜是负极 该装置不能形成原电池 以上说法均不正确
原电池负极被氧化 任何化学反应都能设计成原电池 在原电池内部阳离子向正极区域移动 原电池是把化学能转化为电能的装置
该装置将电能转化为化学能 电子从电极X.转移到电极Y. X.为阳极,表面产生大量气泡 Y.为负极,电极反应为Zn-2e→Zn2+
电流方向:电极Ⅱ→ →电极Ⅰ 电极Ⅱ逐渐溶解 电极Ⅰ上发生还原反应 盐桥中装有含氯化钾的琼脂,Cl¯向右池移动
该原电池的正极反应是Cu2++2e-=Cu 甲烧杯中溶液的血红色逐渐变浅 盐桥中的SO42-流向甲烧杯 若将甲烧杯中的溶液换成稀硝酸,电流表指针反向偏转
该装置能形成原电池,其中铝是负极 该装置能形成原电池,其中铜是负极 该装置不能形成原电池 以上说法均不正确
该原电池中,铜为正极 该原电池中,电子由铜片经过导线流入锌片 该原电池工作一段时间后,溶液的酸性减弱 该原电池工作一段时间后,锌片质量减小
实验①、②说明锌能与稀硫酸反应而铜不能 实验③说明发生原电池反应时会加快化学反应速率 实验③说明在该条件下铜可以与稀硫酸反应生成氢气 实验④说明该原电池中铜为正极、锌为负极
原电池是将化学能转化为电能的装置 在原电池中,电子流出的一极是负极,发生氧化反应 锌、铜、硫酸组成的原电池中,溶液中的 Zn2+、 H+均向正极移动 构成原电池的两个电极必须是活泼性不同的两种金属
若X.为Fe,Y.为Cu,铁为正极 若X.为Fe,Y.为Cu,电子由铜片流向铁片 若X.为Fe,Y.为C.,碳棒上有红色固体析出 若X.为Cu,Y.为Zn,锌片发生还原反应
若X.为Fe,Y.为Cu,铁为正极 若X.为Fe,Y.为Cu,电子由铜片流向铁片 若X.为Fe,Y.为C.,碳棒上有红色固体析出 若X.为Cu,Y.为Zn,锌片发生还原反应
原电池的总反应为Fe+Cu2+═Fe2++Cu 盐桥中是KNO3溶液,则盐桥中NO3-移向乙烧杯 其他条件不变,若将CuCl2溶液换为NH4Cl溶液,石墨电极反应式为2H++2e-═H2↑ 反应前,电极质量相等,一段时间后,两电极质量相差12g,导线中通过0.2mol电子


 电解池中阳极处先变红 电解池中阴极的电极反应式为
电解池中阳极处先变红 电解池中阴极的电极反应式为
