
 NaCl的水溶液是强电解质 23Na37Cl中质子数和中子数之比是8:7 电解熔融氯化钠可得到氯气和金属钠
NaCl的水溶液是强电解质 23Na37Cl中质子数和中子数之比是8:7 电解熔融氯化钠可得到氯气和金属钠
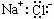 NaCl是强电解质 工业上把电解熔融氯化钠称之为氯碱工业 用侯氏制碱法制备纯碱时发生了氧化还原反应
NaCl是强电解质 工业上把电解熔融氯化钠称之为氯碱工业 用侯氏制碱法制备纯碱时发生了氧化还原反应
 Cl2与Ca(OH)2的反应中,Cl2作氧化剂,Ca(OH)2作还原剂 Cl2与过量的Fe反应的产物为FeCl3 电解熔融态氯化钠的方程式为:2NaCl
Cl2与Ca(OH)2的反应中,Cl2作氧化剂,Ca(OH)2作还原剂 Cl2与过量的Fe反应的产物为FeCl3 电解熔融态氯化钠的方程式为:2NaCl  2Na+Cl2↑
2Na+Cl2↑