你可能感兴趣的试题
0.1 mol锌片投入到100 mL 1 mol・L-1的盐酸溶液中 1 mol MnO2粉末与400 mL10 mol・L-1的盐酸共热 常温下1mol铝片投入到200mL18.4mol・L-1硫酸中 常温下 1 mol铜片投入含4molHNO3的浓硝酸中
①溶液中:c(A-)>c(Na+)>c(OH-)>c(H+) ①溶液中:c(HA)+c(A-)=0.1mol/L 常温下,0.1mol/LHA溶液的pH=1 0.1mol/LHA溶液中:c(HA)>c(A-)
MOH为一元强碱,HA为一元强酸 K点对应的溶液中:c(M+)+c(MOH)=c(A-) K点对应的溶液中:c(MOH)+c(OH-)-c(H+)=0.005mol·L-1 N点水的电离程度小于K.点水的电离程度
常温下,20mL中含X.、Y.各0.003mol的溶液 常温下,100mL中含X.、Y.各0.005mol的溶液 常温下,0.1mol/L.的X.、Y.溶液各l0mL相混合 标准状况下,0.1mol/L.的X.、Y.溶液各l0mL相混合
1mol/L 1.5mol/L 3mol/L 6mol/L
均存在电离平衡与水解平衡 c(OH-): ①>② 存在的粒子种类相同 ②溶液中: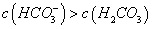
MOH为一元强碱,HA为一元强酸 K点对应的溶液中:c(M+)+c(MOH)=c(A-) K点对应的溶液中:c(MOH)+c(OH-)-c(H+)=0.005mol·L-1 N点水的电离程度小于K.点水的电离程度
由a→b,HA 电离断键时放出热量
c点溶液中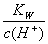 >3×10-3mol/L
>3×10-3mol/L
由d→e,溶液中c(H+)增大,a(HA)减小
e 点溶液中一定有c(H+)>c(HA)
HA为一元强酸 MOH为一元弱碱 N点水的电离程度小于K点水的电离程度 K点对应的pH=10,则有c (MOH)+ c(OH-)-c (H+)=0.005mol·L-1
由题可知HA为弱酸 滴定终点位于c和d这间 滴定到b点时:n(Na+)+n(H.+)-n(OH-)+n(HA)=0.002mol 滴定到d点时:c(OH-)>c(Na+)>c(A.-)>c(H.+)
HA为一元强酸 MOH为一元弱碱 N点水的电离程度小于K.点水的电离程度 若K.点对应的溶液的pH=10,则有c(MOH)+c(OH-)-c(H+)=0.005 mol·L-1
常温下,向100mL CaSO4饱和溶液中, 加入400mL 0.01mol/LNa2SO4溶液后,溶液中有沉淀析出 b点将有沉淀生成,平衡后溶液中c(SO42-)一定等于3×10-3 mol/L d点溶液通过蒸发可以变到c点 a点对应的K.sp等于c点对应的K.sp

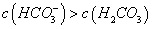
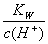 >3×10-3mol/L
>3×10-3mol/L