你可能感兴趣的试题
0.02mol/(L·s) 0.04mol/((L·s) 0.01mol/((L·s) 0.2mol/((L·s)
反应在t1min内的平均速率为 保持其他条件不变,起始时向容器中充入0.60molCO和1.20 molH2O,到达平衡时n(CO2)=0.4mol 保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数减少. 温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应
保持其他条件不变,起始时向容器中充入0.60molCO和1.20 molH2O,到达平衡时n(CO2)=0.4mol 保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数减少. 温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应
Q1>Q3>Q2 =78.8kJ 三个容器中反应的平衡常数均为K=2 甲中反应达到平衡时,若升高温度,则SO2的转化率将大于50% 若乙容器中的反应经tmin达到平衡,则0~tmin内,v(O2)=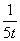 mol/(L.·min)
mol/(L.·min)
反应在t1min内的平均速率为v(H2)=0.40/t1 mol·L-1·min-1 保持其他条件不变,起始时向容器中充入0.60 molCO和1.20 molH2O,到达平衡时,n(CO2)=0.40 mol。 保持其他条件不变,向平衡体系中再通入0.20 mol H2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数增大 温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应
反应在t1min内的平均速率为ν(H2)=0.40/t1 mol·L-1·min-1 保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数减小 保持其他条件不变,起始时向容器中充入0.60molCO和1.20 molH2O,到达平衡时n(CO2)=0.40mol 温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应
在0~2s内,v(O2)=0.002mol·L-1·s-1 在该温度时,向容器中加入O2,平衡将正向移动,平衡常数增大 5s后向容器中通入0.02mol NO2,再次平衡后,0.020mol<n(NO2)<0.040mol 5s后,向反应容器中同时通入各0.01mol的NO、O2、NO2,平衡向正向移动
等于0.6mol/L 小于0.6mol/L 等于0.8mol/L 大于0.8mol/L
反应在t1min内的平均速率为 保持其他条件不变,起始时向容器中充入0.60molCO和1.20 molH2O,到达平衡时 保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数增大 温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应
保持其他条件不变,起始时向容器中充入0.60molCO和1.20 molH2O,到达平衡时 保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数增大 温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应
反应在t1min内的平均速率为v(H2)=0.40/t1 mol·L-1·min-1 保持其他条件不变,起始时向容器中充入0.60 molCO和1.20 molH2O,到达平衡时,n(CO2)=0.40 mol。 保持其他条件不变,向平衡体系中再通入0.20 mol H2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数增大 温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应
平衡时H2O的转化率为40% 反应放出的热量为0.04akJ 判断该反应达到平衡的依据是CO、H2O、CO2、H2的浓度都相等 若将容器的体积压缩为1L,有利于该反应平衡正向移动
和2.5 mol 混合于2L密闭容器中,发生的反应如下:3A(g)+B.(g) xC(g)+2D(g)5min后反应达到平衡,容器内压强变小,测得D.的平均反应速率为0.1mol/(L·min),下列结论正确的是 A.A.的平均反应速率为0.1mol/(L·min) B.平衡时,B.的转化率为20% 平衡时,C.的浓度为0.125 mol/L. 平衡时,容器内的压强为原来的0.875倍
xC(g)+2D(g)5min后反应达到平衡,容器内压强变小,测得D.的平均反应速率为0.1mol/(L·min),下列结论正确的是 A.A.的平均反应速率为0.1mol/(L·min) B.平衡时,B.的转化率为20% 平衡时,C.的浓度为0.125 mol/L. 平衡时,容器内的压强为原来的0.875倍
和 都是4mol,在前10s内A.的平均速率为0.12mol/(L.·s),则10s时容器内B.的物质的量为: A.3.2molB.2.4mol 0.8mol 0.4mol

 保持其他条件不变,起始时向容器中充入0.60molCO和1.20 molH2O,到达平衡时n(CO2)=0.4mol 保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数减少. 温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应
保持其他条件不变,起始时向容器中充入0.60molCO和1.20 molH2O,到达平衡时n(CO2)=0.4mol 保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数减少. 温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应
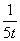 mol/(L.·min)
mol/(L.·min)
 保持其他条件不变,起始时向容器中充入0.60molCO和1.20 molH2O,到达平衡时 保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数增大 温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应
保持其他条件不变,起始时向容器中充入0.60molCO和1.20 molH2O,到达平衡时 保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数增大 温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应
 xC(g)+2D(g)5min后反应达到平衡,容器内压强变小,测得D.的平均反应速率为0.1mol/(L·min),下列结论正确的是 A.A.的平均反应速率为0.1mol/(L·min) B.平衡时,B.的转化率为20% 平衡时,C.的浓度为0.125 mol/L. 平衡时,容器内的压强为原来的0.875倍
xC(g)+2D(g)5min后反应达到平衡,容器内压强变小,测得D.的平均反应速率为0.1mol/(L·min),下列结论正确的是 A.A.的平均反应速率为0.1mol/(L·min) B.平衡时,B.的转化率为20% 平衡时,C.的浓度为0.125 mol/L. 平衡时,容器内的压强为原来的0.875倍