你可能感兴趣的试题
升高温度,可能引起由c向b的变化 该温度下,水的离子积常数为1.0×10-13 该温度下,加入FeCl3可能引起由b向a的变化 该温度下,稀释溶液可能引起由c向d的变化
c(H+)和c(OH-) 溶液的物质的量浓度 溶质的物质的量 所提供的H+和OH-的物质的量
.pH=5的H2S溶液中,c(H+)=c(HS-)=1×10—5 mol·L.—1 .pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1 .pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合: c(Na+)+c(H+)=c(OH-)+c( HC2O4-) .pH相同的①CH3COONa ②NaHCO3 ③NaClO三种溶液的c(Na+):①>②>③
升高温度,可能引起由c向b的变化 该温度下,水的离子积常数为1.0×10-13 该温度下,加入FeCl3可能引起由b向a的变化 该温度下,稀释溶液可能引起由c向d的变化
H2Y的电离方程式:H2Y
 2H++Y2- HY-的水解方程式:HY-+H2O
2H++Y2- HY-的水解方程式:HY-+H2O
 H3O++Y2- 该酸式盐溶液中离子浓度关系:[Na+]>[HY-]>[OH-]>[H+] 该酸式盐溶液中离子浓度关系:[Na+]>[Y2-]>[HY-]>[OH-]>[H+]
H3O++Y2- 该酸式盐溶液中离子浓度关系:[Na+]>[HY-]>[OH-]>[H+] 该酸式盐溶液中离子浓度关系:[Na+]>[Y2-]>[HY-]>[OH-]>[H+]
升高温度,可能引起由c向b的变化 该温度下,水的离子积常数为1.0×10-13 该温度下,加入FeCl3可能引起由b向a的变化 该温度下,稀释溶液可能引起由c向d的变化
含有NH4+、Cl-、H+、OH-离子的溶液中,其离子浓度一定是: c(Cl-)>c(NH4+)>c(H+)>c(OH-) 常温下,pH=8的氨水与氯化铵的混合溶液中:c(Cl-)>c(NH4+) 0.1mol/L 的Na2S溶液中:c(OH-)=c(H+)+c(HS-)+2c(H2S) pH=3的一元酸和pH=11的一元强碱等体积混合后的溶液中:c(OH-)≤c(H+)
升高温度,可能引起有c向b的变化 该温度下,水的离子积常数为1.0×10-13 该温度下,加入FeCl3可能引起由b向a的变化 该温度下,稀释溶液可能引起由c向d的变化
曲线①代表滴定 HCl 溶液的曲线 A.点溶液中:c(CH3COO-)+c(OH-)-c(H+)=0.1 mol·L-1 在相同温度下,A.B.C.三点溶液中水的电离程度:C.<B.=A D.点溶液中:c(Cl-)=2c(OH-)-2c(H+)
升高温度,可能引起由c向b的变化 该温度下,水的离子积常数为1.0×10-13 该温度下,加入FeCl3可能引起由b向a的变化 该温度下,稀释溶液可能引起由c向d的变化 
改变温度,可能引起由c向b的变化 该温度下,水的离子积常数为1.0×10-13 该温度下,加入NaOH可能引起由b向a的变化 该温度下,稀释溶液不可能引起由c向d的变化
某温度下,不论何种水溶液中c(H+)·c(OH-)乘积相等,即水的离子积是一个常数 醋酸钠和醋酸的混合液中若c(Na+)=c(CH3COO-),则溶液中c(H+)=c(OH-) 如果定义pOH=-lgc(OH-),则常温下某水溶液中的pOH和pH之和等于14 某水溶液由于条件的改变,如果氢离子浓度变小,则氢氧根离子浓度一定变大
NaHC0中含有氢,故其水溶液呈酸性 浓HAc(17mol/L)的酸度大于17mol/LH2S04水溶液的酸度 浓度(单位:mol/L)相等的一元酸和一元碱反应后,其溶液呈中性 当[H+]大于[OH-]时,溶液呈酸性 当[H+]大于[OH-]时,溶液呈碱性
升高温度,可能引起由c向b的变化 该温度下,水的离子积常数为1.0×10-13 该温度下,加入FeCl3可能引起由b向a的变化 该温度下,稀释溶液可能引起由c向d的变化 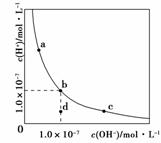
升高温度,可能引起由c向b的变化 该温度下,水的离子积常数为1.0×10-13 该温度下,加入FeCl3可能引起由b向a的变化 该温度下,稀释溶液可能引起由c向d的变化
HCl CH3COOH H2CO3 Ba(OH)2
升高温度,可能引起由c向b的变化 该温度下,水的离子积常数为1.0×10-13 该温度下,加入FeCl3可能引起由b向a的变化 该温度下,稀释溶液可能引起由c向d的变化


 2H++Y2- HY-的水解方程式:HY-+H2O
2H++Y2- HY-的水解方程式:HY-+H2O
 H3O++Y2- 该酸式盐溶液中离子浓度关系:[Na+]>[HY-]>[OH-]>[H+] 该酸式盐溶液中离子浓度关系:[Na+]>[Y2-]>[HY-]>[OH-]>[H+]
H3O++Y2- 该酸式盐溶液中离子浓度关系:[Na+]>[HY-]>[OH-]>[H+] 该酸式盐溶液中离子浓度关系:[Na+]>[Y2-]>[HY-]>[OH-]>[H+]

