你可能感兴趣的试题
由0.1 mol· 一元碱BOH溶液的pH=10,可推知BOH溶液存在BOH⇋
一元碱BOH溶液的pH=10,可推知BOH溶液存在BOH⇋ 在pH = 12的溶液中,
在pH = 12的溶液中, 、Cl-、
、Cl-、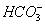 、
、 可以大量共存 在pH= 0的溶液中,
可以大量共存 在pH= 0的溶液中, 、
、 、
、 、
、 可以大量共存 在25℃下,pH=2的一元酸和pH=12的一元强碱等体积混合:c( OH-)= c(H+)
可以大量共存 在25℃下,pH=2的一元酸和pH=12的一元强碱等体积混合:c( OH-)= c(H+)
HA为弱酸,BOH为强碱 a点时,溶液中粒子浓度存在关系: c(B.+) > c(Cl-) > c(OH-) > c(BOH) c、d两点溶液混合后微粒之间存在关系: c(H+) = c(OH-) + c(BOH) b点时两种溶液中水的电离程度相同,且V.=20
滴定管用蒸馏水洗涤后,装入NaOH溶液进行滴定 随着NaOH溶液滴入,锥形瓶中溶液pH由小变大 用酚酞作指示剂,当锥形瓶中溶液由红色变无色时停止滴定 滴定达终点时,发现滴定管尖嘴部分有悬滴,则测定结果偏小
10℃20mL3 molL﹣1的X溶液 20℃30 mL 2 molL﹣1的X溶液 20℃10 mL 4 molL﹣1的X溶液 10℃10 mL 2 molL﹣1的X溶液
BOH溶于水,其电离方程式是BOH=B++OH- 若一定量的上述两溶液混合后pH=7,则c(A—)=c(B+) 在0.1 mol·L-lBA溶液中,c(B+)>c(A.一)> c(OH-)>c(H+) 若将0.1mol·L-lBOH溶液稀释至0.001mol·L-1,则溶液的pH=9
V0= 45.00 滴定曲线①表示KCl的滴定曲线 滴定KCl时,可加入少量的KI作指示剂 当AgNO3溶液滴定至60.00mL 时,溶液中 c(I-)-)-)
HA为弱酸,BOH为强碱
a点时,溶液中粒子浓度存在关系:C(B+)>c(Cl﹣)>c(OH﹣)>c(BOH )
b点时两种溶液中水的电离程度相同,且V=20
c.d两点溶液混合后微粒之间存在关系c (H+)═c(OH﹣)+c(BOH)
BOH一定是弱碱 是浓的弱酸溶液和稀的强碱溶液的混合 混合溶液中的溶质为BA和BOH 混合溶液中水的电离程度较纯水中大
滴定盐酸的曲线是图2 达到B.D.状态时,两溶液中离子浓度均为c(Na+) = c(A—) 达到B.E.状态时,反应消耗的n(CH3COOH)>n(HCl) 当0 mL< V(NaOH) <20. 00 mL时,对应混合溶液中各离子浓度由大到小的顺序均为 c(A—) >c(Na+)> c(H+) > c(OH—)
滴定管用蒸馏水洗涤后,装入NaOH溶液进行滴定 用酚酞作指示剂,当锥形瓶中溶液由红色变无色时停止滴定 用25 mL酸式滴定管量取20.00mL待测HCl溶液于锥形瓶中 滴定达终点时,发现滴定管尖嘴部分有悬滴,则测定结果偏小
a点时,溶液呈碱性,溶液中c(B+)>c(Cl-) b点时溶液的pH=7 当c(Cl-)=c(B+)时,V.(HCl)<20 mL c点时溶液中c(H+)约为0.03 mol·L-1
 一元碱BOH溶液的pH=10,可推知BOH溶液存在BOH⇋
一元碱BOH溶液的pH=10,可推知BOH溶液存在BOH⇋ 在pH = 12的溶液中,
在pH = 12的溶液中, 、Cl-、
、Cl-、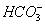 、
、 可以大量共存 在pH= 0的溶液中,
可以大量共存 在pH= 0的溶液中, 、
、 、
、 、
、 可以大量共存 在25℃下,pH=2的一元酸和pH=12的一元强碱等体积混合:c( OH-)= c(H+)
可以大量共存 在25℃下,pH=2的一元酸和pH=12的一元强碱等体积混合:c( OH-)= c(H+)