
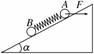
 A.弹簧伸长量为mgsinα/k 水平面对斜面体支持力大小等于斜面体和物体A.的重力之和 物体A.对斜面体的压力大小为mgcosα 斜面体受地面的静摩擦力大小等于F.cosα
A.弹簧伸长量为mgsinα/k 水平面对斜面体支持力大小等于斜面体和物体A.的重力之和 物体A.对斜面体的压力大小为mgcosα 斜面体受地面的静摩擦力大小等于F.cosα
 A.水平面对斜面体支持力小于斜面体和物体A.的重力之和 弹簧伸长量为mg/k 物体A.对斜面体的压力大小为mgcosα 斜面体受地面的静摩擦力大小等于Fcosα,方向水平向左
A.水平面对斜面体支持力小于斜面体和物体A.的重力之和 弹簧伸长量为mg/k 物体A.对斜面体的压力大小为mgcosα 斜面体受地面的静摩擦力大小等于Fcosα,方向水平向左
 A.弹簧的原长为L.+
A.弹簧的原长为L.+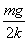 B.水平恒力大小为
B.水平恒力大小为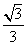 mg 撤掉恒力的瞬间小球A.的加速度为g 撤掉恒力的瞬间小球B.的加速度为g
mg 撤掉恒力的瞬间小球A.的加速度为g 撤掉恒力的瞬间小球B.的加速度为g
 图8 A.l+,2mgB.l+,mg l-,2mg l-,mg
图8 A.l+,2mgB.l+,mg l-,2mg l-,mg
 A.弹簧伸长量为mgsinα/k 水平面对斜面体的支持力大小等于斜面体和物体A.的重力之和 物体A.对斜面体的压力大小为mgcosα 斜面体受地面的静摩擦力大小等于F.cosα
A.弹簧伸长量为mgsinα/k 水平面对斜面体的支持力大小等于斜面体和物体A.的重力之和 物体A.对斜面体的压力大小为mgcosα 斜面体受地面的静摩擦力大小等于F.cosα
 A.0B.2gsinθ,方向沿斜面向下 2gsinθ,方向沿斜面向上 gsinθ,方向沿斜面向下
A.0B.2gsinθ,方向沿斜面向下 2gsinθ,方向沿斜面向上 gsinθ,方向沿斜面向下
