
 O2(g) == CO2(g) +2H2O(g) ΔH.== -akJ·mol—1 ,这里ΔH.代表燃烧热 CO是不稳定的氧化物,它能继续和氧气反应生成稳定的CO2,所以CO的燃烧反应一定是吸热反应 在25℃、101kPa,1molS和2molS的燃烧热相等 101kPa时,1mol碳燃烧所放出的热量为碳的燃烧热
O2(g) == CO2(g) +2H2O(g) ΔH.== -akJ·mol—1 ,这里ΔH.代表燃烧热 CO是不稳定的氧化物,它能继续和氧气反应生成稳定的CO2,所以CO的燃烧反应一定是吸热反应 在25℃、101kPa,1molS和2molS的燃烧热相等 101kPa时,1mol碳燃烧所放出的热量为碳的燃烧热
 O2(g)====CO(g);ΔH=-393.5 kJ·mol-1 2H2(g)+O2(g)====2H2O(g);ΔH=+571.6 kJ·mol-1 CH4(g)+2O2(g)====CO2(g)+2H2O(g);ΔH=-890.3 kJ·mol-1
O2(g)====CO(g);ΔH=-393.5 kJ·mol-1 2H2(g)+O2(g)====2H2O(g);ΔH=+571.6 kJ·mol-1 CH4(g)+2O2(g)====CO2(g)+2H2O(g);ΔH=-890.3 kJ·mol-1  C.6H12O6(s)+3O2(g)====3CO2(g)+3H2O(l);ΔH=-1 400 kJ·mol-1
C.6H12O6(s)+3O2(g)====3CO2(g)+3H2O(l);ΔH=-1 400 kJ·mol-1
 O2(g)=CO(g) ΔH. =―393.5 kJ/mol 2H2(g)+O2(g)=2H2O(l) ΔH. = +571.6 kJ/mol CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH. =―890.3 kJ/mol C6H12O6(s) +6O2(g)=6CO2(g)+6H2O(l) ΔH. =―2800 kJ/mol
O2(g)=CO(g) ΔH. =―393.5 kJ/mol 2H2(g)+O2(g)=2H2O(l) ΔH. = +571.6 kJ/mol CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH. =―890.3 kJ/mol C6H12O6(s) +6O2(g)=6CO2(g)+6H2O(l) ΔH. =―2800 kJ/mol
 O2(g)=CO(g) △H= ―393.5 kJ/mol 2H2(g)+O2(g)=2H2O(l) △H= +571.6 kJ/mol CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H= ―890.3 kJ/mol C.6H12O6(s) +6O2(g)=6CO2(g)+6H2O(l) △H= ―2800 kJ/mol
O2(g)=CO(g) △H= ―393.5 kJ/mol 2H2(g)+O2(g)=2H2O(l) △H= +571.6 kJ/mol CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H= ―890.3 kJ/mol C.6H12O6(s) +6O2(g)=6CO2(g)+6H2O(l) △H= ―2800 kJ/mol
 O2(g)=CO(g) △H.= 393.5 kJ/mol 2H2(g)+O2(g)=2H2O(l) △H.= +571.6 kJ/mol CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H.= 890.3 kJ/mol C6H12O6(s) +6O2(g)=6CO2(g)+6H2O(l) △H.= 2800 kJ/mol
O2(g)=CO(g) △H.= 393.5 kJ/mol 2H2(g)+O2(g)=2H2O(l) △H.= +571.6 kJ/mol CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H.= 890.3 kJ/mol C6H12O6(s) +6O2(g)=6CO2(g)+6H2O(l) △H.= 2800 kJ/mol
 O2(g)=CO(g) △H.= ―393.5 kJ/mol 2H2(g)+O2(g)=2H2O(l) △H.= +571.6 kJ/mol CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H.= ―890.3 kJ/mol C6H12O6(s) +6O2(g)=6CO2(g)+6H2O(l) △H.= ―2800 kJ/mol
O2(g)=CO(g) △H.= ―393.5 kJ/mol 2H2(g)+O2(g)=2H2O(l) △H.= +571.6 kJ/mol CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H.= ―890.3 kJ/mol C6H12O6(s) +6O2(g)=6CO2(g)+6H2O(l) △H.= ―2800 kJ/mol
 O2(g)=CO(g);△H= - 393.5 kJ/mol 2H2(g)+O2(g)=2H2O(l);△H=+571.6 kJ/mol CH4(g)+CO2(g)=CO2(g)+2H2O(g);△H=-890.3 kJ/mol
O2(g)=CO(g);△H= - 393.5 kJ/mol 2H2(g)+O2(g)=2H2O(l);△H=+571.6 kJ/mol CH4(g)+CO2(g)=CO2(g)+2H2O(g);△H=-890.3 kJ/mol  C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l);△H=-1400 kJ/mol
C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l);△H=-1400 kJ/mol
 O2(g)=CO(g) ΔH=-393.5kJ/mol
O2(g)=CO(g) ΔH=-393.5kJ/mol C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l) ΔH=-1400kJ/mol
C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l) ΔH=-1400kJ/mol
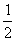 O2(g)=CO(g) △H.= -393.5 kJ/mol 2H2(g)+O2(g)=2H2O(g) △H.=+571.6 kJ/mol CH4g)+2O2(g)=CO2(g)+2H2O(g) △H.= -890.3 kJ/mol
O2(g)=CO(g) △H.= -393.5 kJ/mol 2H2(g)+O2(g)=2H2O(g) △H.=+571.6 kJ/mol CH4g)+2O2(g)=CO2(g)+2H2O(g) △H.= -890.3 kJ/mol 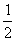 C6H.12O.6(s)+3O2(g)=3CO2(g)+3H2O(l) △H.= -1 400 kJ/mol
C6H.12O.6(s)+3O2(g)=3CO2(g)+3H2O(l) △H.= -1 400 kJ/mol
 O2(g)=CO(g) △H.= ―393.5 kJ/mol 2H2(g)+O2(g)=2H2O(l) △H.= +571.6 kJ/mol CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H.= ―890.3 kJ/mol C6H12O6(s) +6O2(g)=6CO2(g)+6H2O(l) △H.=―2800 kJ/mol
O2(g)=CO(g) △H.= ―393.5 kJ/mol 2H2(g)+O2(g)=2H2O(l) △H.= +571.6 kJ/mol CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H.= ―890.3 kJ/mol C6H12O6(s) +6O2(g)=6CO2(g)+6H2O(l) △H.=―2800 kJ/mol
 O2(g)=CO(g);△H.=-393.5 kJ/mol 2H2(g)+O2(g)=2H2O(g);△H.=+571.6 kJ/mol CH4g)+2O2(g)=CO2(g)+2H2O(g);△H.=-890.3 kJ/mol
O2(g)=CO(g);△H.=-393.5 kJ/mol 2H2(g)+O2(g)=2H2O(g);△H.=+571.6 kJ/mol CH4g)+2O2(g)=CO2(g)+2H2O(g);△H.=-890.3 kJ/mol  C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l);△H.=-1 400 kJ/mol
C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l);△H.=-1 400 kJ/mol
 O2(g) == CO(g) +2H2O(l) ΔH== -akJ·mol—1 , 这里ΔH.代表燃烧热 在250 101kPa,1mol硫和2mol硫的燃烧热相等 C.CO是不稳定的氧化物,它能继续和氧气反应生成稳定的CO2,所以CO的燃烧反应一定是吸热反应 101kPa时,1mol碳燃烧所放出的热量为碳的燃烧热
O2(g) == CO(g) +2H2O(l) ΔH== -akJ·mol—1 , 这里ΔH.代表燃烧热 在250 101kPa,1mol硫和2mol硫的燃烧热相等 C.CO是不稳定的氧化物,它能继续和氧气反应生成稳定的CO2,所以CO的燃烧反应一定是吸热反应 101kPa时,1mol碳燃烧所放出的热量为碳的燃烧热
 O2(g)=CO(g) △H.= ―393.5 kJ/mol 2H2(g)+O2(g)=2H2O(l) △H.= +571.6 kJ/mol CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H.= ―890.3 kJ/mol C6H12O6(s) +6O2(g)=6CO2(g)+6H2O(l) △H.=―2800 kJ/mol
O2(g)=CO(g) △H.= ―393.5 kJ/mol 2H2(g)+O2(g)=2H2O(l) △H.= +571.6 kJ/mol CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H.= ―890.3 kJ/mol C6H12O6(s) +6O2(g)=6CO2(g)+6H2O(l) △H.=―2800 kJ/mol