你可能感兴趣的试题
原子序数=核电荷数 周期序数=电子层数 主族序数=最外层电子数 族元素最外层电子数为8
B.C.D.,原子序数依次增大;A.C.的原子序数的差为8,A. C.三种元素原子的最外层电子数之和为15,B.原子最外层电子数等于A.原子最外层电子数的一半。下列叙述正确的是( ) A.原子半径:A.<B.< <DB.非金属性:A.>C. C.最高价氧化物对应水化物的酸性: <CD.单质B.在常温下能溶于浓硝酸
X.和R.在同一周期
原子半径:W.>R.>X
气态氢化物的稳定性:Y.>X
X.、Z.形成的化合物中只有离子键
B.C.D.,原子序数依次增大。A.C.的原子序数的差为8,A. C.三种元素原子的最外层电子数之和为15,B.原子最外层电子数等于A.原子最外层电子数的一半。下列叙述正确的是( ) A.原子半径:A.<B.< <DB.非金属性:C.>A. C.最高价氧化物对应水化物的酸性: >CD.单质B.常温下能溶于浓硝酸
该图体现出原子核外电子层呈现周期性变化 简单离子半径:W.->R2->X+>S3+ R.、Z.形成的化合物中可能含有共价键 由酸性: HWO4>H2RO3可证明非金属性:W>R
该图体现出原子核外电子层呈现周期性变化 原子半径:W>R>X X.、Z.形成的化合物中可能含有共价键 W.的氢化物与R.的氢化物水溶液的酸性比较,前者强于后者,可证明非金属性:R>W
B属于短周期中不同主族的元素,A.B原子的最外层电子中,成对电子和未成对电子占据的轨道数相等,若A元素的原子序数为a,则B元素的原子序数不可能为( )
A.a﹣4 a﹣5 a+3 a+11
X.与W.形成的化合物中只有共价键 X.与Z.形成的化合物中只有离子键 元素的非金属性:X.>R.>W. 简单离子的半径:W.>R.>X.
X.和R.在同一周期 原子半径:W.>R.>X. 气态氢化物的酸性:X.>Y. X.、Z.形成的化合物中阴阳离子个数比为1: 2
ZY、ZW、W2X的水溶液都显酸性 原子半径大小:W.>R.>X., 简单离子半径大小:R >W >X W.的氢化物与R.的氢化物水溶液的酸性比较,前者强于后者,可证明非金属性:R>W Z.与X.,Z.与R.两种元素形成的化合物中均可能存在共价键 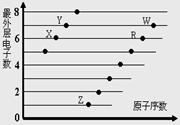
该图体现出原子核外电子层呈现周期性变化 原子半径:W>R>X X.、Z.形成的化合物中可能含有共价键 W.的氢化物与R.的氢化物水溶液的酸性比较,前者强于后者,可证明非金属性:R>W
X.与W.形成的化合物中只有共价键 X.与Z.形成的化合物中只有离子键 元素的非金属性:X.>R.>W. 简单离子的半径:W.>R.>X.
该图体现出原子核外电子层呈现周期性变化 原子半径:W>R>X X.、Z.形成的化合物中可能含有共价键 W.的氢化物与R.的氢化物水溶液的酸性比较,前者强于后者,可证明非金属性:R>W
B.C.D.,原子序数依次增大。A.C.的原子序数的差为8,A. C.三种元素原子的最外层电子数之和为15,B.原子最外层电子数等于A.原子最外层电子数的一半。下列叙述正确的是 A.原子半径:A.<B.< <DB.单质B.常温下能溶于浓硝酸 C.最高价氧化物对应水化物的酸性: <CD.非金属性:A.>C.
B.C.D.的原子序数依次递增,它们的原子序数之和为34,且原子的最外层电子数之和为10;A.C.的原子最外层电子数之和等于 原子的次外层电子数;A.与 ,B.与 均为同主族元素。下列叙述正确的是 ( ) A.B.D.的最高价氧化物都不能和任何酸反应 B. 最高价氧化物对应水化物的碱性:A
X.和R.在同一周期
原子半径:W.>R.>X
气态氢化物的稳定性:Y.>X
X.、Z.形成的化合物中只有离子键
X.与W.形成的化合物中只有共价键 X.与Z.形成的化合物中只有离子键 元素的非金属性:X.>R.>W. 简单离子的半径:W.>R.>X.
元素非金属性:X.>R.>W. X.与R.形成的分子内含两种作用力 元素对应的离子半径:W.>R.>Y. X.、Z.形成的化合物中可能含有共价键

