你可能感兴趣的试题
容器Ⅰ、Ⅱ中正反应速率相同 容器Ⅰ、Ⅲ中反应的平衡常数相同 容器Ⅰ中CO 的物质的量和容器Ⅱ中的一样多 容器Ⅰ中CO 的转化率与容器Ⅱ中CO2 的转化率之和小于1
Q1>Q3>Q2 =78.8kJ 三个容器中反应的平衡常数均为K=2 甲中反应达到平衡时,若升高温度,则SO2的转化率将大于50% 若乙容器中的反应经tmin达到平衡,则0~tmin内,v(O2)=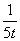 mol/(L.·min)
mol/(L.·min)
恒温恒容条件下,加入适当催化剂 恒温条件下,缩小反应容器体积 恒容条件下升高温度 恒温条件下,扩大反应容器体积
容器Ⅰ中CO 的物质的量比容器Ⅱ中的多 容器Ⅰ、Ⅲ中反应的平衡常数相同 容器Ⅰ、Ⅱ中正反应速率相同 容器Ⅰ中CO 的转化率与容器Ⅱ中CO2的转化率之和等于1
若x<4,则2c1若x=4,则ω1=ω3 无论x的值是多少,均有2ρ1=ρ2内 容器甲中反应从开始到平衡的平均反应速率可能为vA.=0.3mol·L-1·min-1
达到平衡时再充入2mol SO2反应的△H.保持不变。 用O2表示4min内的反应速率为0.1mol·(L.·min)-1 再向容器中充入1mol SO3,达到新平衡,ν(SO2)∶ν(O2)=2∶1 4min后,若升高温度,平衡向逆反应方向移动,平衡常数K.增大
恒温恒容条件下,加入适当催化剂 恒温条件下,缩小反应容器体积 恒容条件下升高温度 恒温条件下,扩大反应容器体积
B.C.物质的量随反应时间的变化如图所示,下列有关说法不正确的是 A.反应在前10s 内v =0.005mol/(L.s) B.方程式计量数a:b:c为2:1:2 10 s时改变条件可能是升高温度,20s时平衡逆向进行 15~20s间,反应的平衡常数是2.7
容器Ⅰ、Ⅱ中正反应速率相同 容器Ⅰ、Ⅲ中反应的平衡常数相同 容器Ⅰ中CO的物质的量比容器Ⅱ中的少 容器Ⅰ中CO的转化率与容器Ⅱ中CO2的转化率之和小于1
恒温恒容条件下,加入适当催化剂 恒温条件下,缩小反应容器体积 恒温条件下,扩大反应容器体积 恒容条件下升高温度
恒容条件下升高温度 恒温恒容条件下加入适当的催化剂 恒温条件下扩大反应容器的体积 增大反应物中H2的浓度
该反应为吸热反应 容器Ⅲ达到平衡时,再充入少量氦气,平衡将向正反应方向移动 容器Ⅱ达到平衡时,容器中COS的物质的量浓度为0.025 mol • L-1 607K.时,该反应的平衡常数为0.50

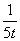 mol/(L.·min)
mol/(L.·min)
