
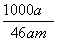 mol·L-1
mol·L-1  mol·L-1
mol·L-1  mol·L-1
mol·L-1  mol·L-1
mol·L-1
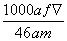 mol·L-1
mol·L-1  mol·L-1
mol·L-1 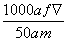 mol·L-1
mol·L-1 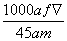 mol·L-1
mol·L-1
 所得气体体积为44.8aL 向溶液中通入过量CO2,未见白色沉淀 该溶液的质量分数:
所得气体体积为44.8aL 向溶液中通入过量CO2,未见白色沉淀 该溶液的质量分数: 
 mol·L-1
mol·L-1 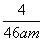 mol·L-1
mol·L-1 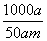 mol·L-1
mol·L-1  mol·L-1
mol·L-1
 mol·L-1
mol·L-1  mol·L-1
mol·L-1  mol·L-1
mol·L-1 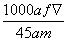 mol·L-1
mol·L-1