你可能感兴趣的试题
溶液的导电能力:a > b > c > d 溶液的pH大小:a< b < c < d a、b溶液呈酸性 c、d溶液呈碱性 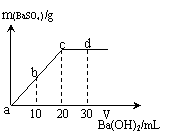
HA为强 该混合溶液的pH=7.0 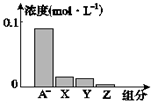 该混合溶液中c(Aˉ)+c(Y)=c(Na+) 图中X.表示HA,Y.表示OH-,Z.表示H+
该混合溶液中c(Aˉ)+c(Y)=c(Na+) 图中X.表示HA,Y.表示OH-,Z.表示H+
)常温下都可用铁制容器贮存 ( )常温下都能与铜较快反应 ( )露置于空气中,溶液质量均减轻 ( )露置于空气中,溶液浓度均降低
常温下,pH = 7的NH4Cl与氨水的混合溶液中离子浓度大小顺序为 c(Cl-) > c(NH4+) > c(H+) > c(OH-) 将pH = 4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同 常温下,同浓度的Na2S与NaHS溶液相比,Na2S溶液的pH大
常温下都可用铁质容器贮存 常温下都能与铜较快反应 露置于空气中,溶液质量均减轻 露置于空气中,溶液浓度均降低
常温下,pH=7的NH4Cl与氨水的混合溶液中离子浓度大小顺序为C.(Cl-)>C.(NH4+)>C.(H+)>C.(OH―) 在纯水中加入少量硫酸或硫酸铵,均可抑制水的电离 中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同 常温下,同浓度的Na2S与NaHS溶液相比,Na2S溶液的PH大
常温下,pH=7的NH4Cl与氨水的混合溶液中离子浓度大小顺序为 C.(Cl-)>C.(NH4+)>C.(H.+)>C.(OH-) 将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同 常温下,同浓度的Na2S与NaHS溶液相比,Na2S溶液的pH大
常温下,在pH=8的NaA溶液中:c(Na+)-c(A-)=9.9×10-7 mol·L-1 由10 mL 0.1 mol·L-1的CH3COOH溶液与10 mL 0.1 mol·L-1的NaOH溶液混合,离子浓度大小的顺序:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) 室温下,由pH=1的CH3COOH溶液与pH=13的NaOH溶液等体积混合,浓度大小的顺序:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) 常温下,0.1 mol·L-1 pH=8的NaHB溶液中:c(B2-)>c(H2B.)
常温下,pH=7的NH4Cl与氨水的混合溶液中离子浓度大小顺序为:c(Cl-)>c(NH4+)>c(H+)=c(OH-) 将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同 常温下,同浓度的Na2S与NaHS溶液相比,Na2S溶液为pH大
常温下,pH=7的NH4C.l与氨水的混合溶液中离子浓度大小顺序为 c(Cl-)>c(NH4+)>c(H+)>c(OH-) 将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同 常温下,同浓度的Na2S与NaHS溶液相比,Na2S溶液的pH大
常温下,pH=7的NH4Cl与氨水的混合溶液中离子浓度大小顺序为: c (Cl-)>c (NH4+)>c (H+)> c (OH-) 将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同 常温下,同浓度的Na2S与NaHS溶液相比,Na2S溶液的pH大
该溶液中水电离出来的
溶液中离子浓度关系:
该溶液的
加入等浓度等体积的盐酸,溶液中:
)t℃时,某溶液的pH=6,则该溶液一定为酸性 ( )常温下,将pH=11的氨水稀释后,溶液中所有离子的浓度均降低 ( )常温下,将pH=11的NaOH溶液和pH=3的CH3COOH溶液等体积混合后,溶液的pH<7 ( )常温下,物质的量浓度和体积相同的K2CO3、K2SO4、HC1溶液混合后,溶液的 pH<7
0.1mol/L.的NaHCO3溶液中离子浓度关系:c(Na+)=2c(CO32-)+c(HCO3-)+c(H2CO3) 0.1mol/L NH4Cl溶液中离子浓度关系: c(Cl-)>c(NH4+)>c(H+)>c(OH-) 常温下,在PH=1的溶液中,Fe2+、NO3-、ClO-、Na+能大量共存 常温下,向醋酸钠溶液中滴加少量醋酸使溶液的PH=7,则混合液中: c(Na+)=c(CH3COO-)
常温下都可用铁制容器贮存 常温下都能与铜较快反应 露置于空气中,溶液质量均减轻 露置于空气中,溶液浓度均降低
常温下,pH=7的 NH4Cl与氨水的混合溶液中离子浓度大小顺序为 c (CI-)>c(NH4+ ) >c ( H+ )= (OH-) 将 pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 中和 pH与体积均相同的盐酸和醋酸溶液,消耗 NaOH的物质的量相同 常温下,同浓度的 Na2S与 NaHS溶液相比,Na2S溶液为 pH大
常温下,pH等于14与pH等于12的两种NaOH溶液等体积混合后, c(H+)=(10-14+10-10)/2 常温下,浓度为1×10-10 mol·L.-1的KOH溶液的pH为7 氨水加水稀释,溶液中除水以外的所有粒子的浓度都减小 常温下,pH等于1的盐酸溶液中水的电离程度与pH等于13的Ba(OH)2溶液中水的电离程度相等
t℃时,某溶液的pH=6,则该溶液一定为酸性 常温下,将pH=11的氨水稀释后,溶液中所有离子的浓度均降低 常温下,将pH=11的NaOH溶液和pH=3的CH3COOH溶液等体积混合后,溶液pH<7 常温下,物质的量浓度和体积相同的K2CO3、K2SO4、HC1溶液混合后,溶液的pH<7
HA是强酸,HB是弱酸 升高温度,溶液②中增大 溶液①中离子浓度的关系:c(A-)>c(Na+)>c(OH-)>c(H+) 溶液②中离子浓度的关系:c(Na+)+c(H+)+c(B-)=0.12 mol·L-1
常温下,向醋酸溶液中加入少量的水,溶液中所有离子浓度均将减小 常温下,pH相同的NaOH溶液和Ba(OH)2溶液中,水的电离程度相同 向NaHCO3溶液中加入少量的澄清石灰水,所得溶液的pH不变 常温下,2NO(g)+2CO(g)=N2(g)+2CO2(g)能自发进行,则该反应的△H>O


 该混合溶液中c(Aˉ)+c(Y)=c(Na+) 图中X.表示HA,Y.表示OH-,Z.表示H+
该混合溶液中c(Aˉ)+c(Y)=c(Na+) 图中X.表示HA,Y.表示OH-,Z.表示H+



