
 A. a-b时沉淀的物质的量:A.1(OH)3比BaSO4多 d-e时溶液中离子的物质的量:Ba2+可能等于OH- a-d时沉淀的物质的量:BaSO4可能小于A.1(OH)3 c-d时溶液中离子的物质的量:【Al(OH)4】-比Ba2+少
A. a-b时沉淀的物质的量:A.1(OH)3比BaSO4多 d-e时溶液中离子的物质的量:Ba2+可能等于OH- a-d时沉淀的物质的量:BaSO4可能小于A.1(OH)3 c-d时溶液中离子的物质的量:【Al(OH)4】-比Ba2+少
 mol/L
mol/L  mol/L
mol/L  mol/L 无法计算
mol/L 无法计算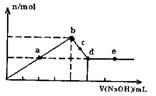 A.a、c两点沉淀物成份相同,d、e两点沉淀物成份相同 b点溶液的中c(Na+)=c( 1—)C.b-c段与c-d段溶液中阴离子的物质的量相等 在d点,向溶液中加入少量盐酸,沉淀量将减少
A.a、c两点沉淀物成份相同,d、e两点沉淀物成份相同 b点溶液的中c(Na+)=c( 1—)C.b-c段与c-d段溶液中阴离子的物质的量相等 在d点,向溶液中加入少量盐酸,沉淀量将减少