你可能感兴趣的试题
S(s)+O2(g)===SO2(g),反应放出的热量大于293.23kJ·mol-1 S(g)+O2(g)===SO2(g),反应放出的热量小于293.23kJ·mol-1 1mol SO2的键能的总和大于1mol硫和1mol氧气的键能之和 1mol SO2的键能的总和小于1mol硫和1mol氧气的键能之和
从C.(石墨)=C.(金刚石) △H.=+1.9kJ·mol-1,可知石墨比金刚石更稳定 等质量的硫蒸气和硫固体分别完全燃烧,后者放出热量更多 由H+(aq)+OH-(aq)= H2O(l) △H.=-57.3 kJ·mol-1,可知:含1mol CH3COOH的溶液与含1mol NaOH的溶液混合,放出热量等于57.3 kJ 2gH2完全燃烧生成液态水放出285.8kJ热量,则氢气燃烧的热化学方程式为: 2H2(g)+O2(g)= 2 H2O(l) △H.=-285.8 kJ·mol-1
等质量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 由 (石墨)→C(金刚石);ΔH=+119kJ•mol-1可知,金刚石比石墨稳定C.在稀溶液中:H++OH-===H2O;ΔH=-57.3kJ•mol-1,若将含0.5molH2SO4的浓硫酸与含1mol NaOH的烧碱溶液混合,放出的热量大于57.3Kj 1L 0.5mol・L-1稀硫酸与1L 1mol・L-1氢氧化钠溶液反应放出57.3kJ的热量:H2SO4(aq)+2NaOH(aq) === Na2SO4(aq)+2H2O(1);ΔH=-57.3kJ/mol
含1 mol NH3分子 含NH3和NH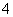 之和为1mol 含NH3、NH
之和为1mol 含NH3、NH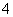 、NH3·H2O之和为1 mol 含NH3·H2O 1mol
、NH3·H2O之和为1 mol 含NH3·H2O 1mol
S(s,单斜)===S(s,正交) ;△H3 = -0.33kJ.·mol-1 单斜硫比正交硫稳定 相同物质的量的正交硫比单斜硫所含有的能量高 ②式表示断裂lmol O2中的共价键所吸收的能量比形成1mol SO2中的共价键所放出的能量多296.83kJ
1L水中溶解1mol硫酸 将98g浓硫酸溶于水配成1L溶液 1L溶液中含1mol H2SO4分子 指1L硫酸溶液中溶了98g硫酸
1mol Zn与含1mol HCl的稀盐酸共热 1mol Cu与含2mol H2SO4的浓硫酸共热 1mol Cu与含4mol HNO3的浓硝酸 1mol MnO2与含4mol HCl的浓盐酸共热
S(s,单斜) = S(s,正交) △H3 = +0.33kJ·mol -1 正交硫比单斜硫稳定 相同物质的量的正交硫比单斜硫所含有的能量高 ①式表示断裂lmol O2中的共价键所吸收的能量比形成1mol SO2中的共价键所放出的能量多297.16kJ
S(g)+O2(g)=SO2(l) |△H|>297. 3kJ/mol S(g)+O2(g)=SO2(l) △H<-297. 3kJ/mol 1mol SO2(g)的键能总和小于1mol S(g)和1mol O2(g)键能之和 1mol SO2(g)的键能总和大于1mol S(g)和1mol O2(g)键能之和
H2SO4的摩尔质量是98 2mol NO和2mol N2含分子数相同 1mol Cl2的质量是71g 标准状况下1mol O2与1mol H2气体所占的体积都约为22.4L
1L0.1mol/L醋酸 0.1L 0.1mol/L H2SO4溶液 0.5L 0.1mol/L盐酸 2L 0.1mol/L H2SO3溶液
溶液中含1mol Na2SO4. 1L溶液中含142g Na2SO4. 1mol Na2SO4溶于1L水中. 将322g Na2SO4·10H2O溶于少量水中后再稀释成1000mL.

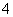 之和为1mol 含NH3、NH
之和为1mol 含NH3、NH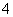 、NH3·H2O之和为1 mol 含NH3·H2O 1mol
、NH3·H2O之和为1 mol 含NH3·H2O 1mol