你可能感兴趣的试题
向粗盐溶液中滴加盐酸和BaCl2溶液,产生白色沉淀,则说明粗盐中含有SO42- 向精盐溶液中滴加盐酸和BaCl2溶液,无明显现象,则说明精盐中不含SO42- 向蒸馏水中滴加稀HNO3和AgNO3溶液,产生白色沉淀,则说明蒸馏水中含有Cl- 向自水中滴加稀HNO3和AgNO3溶液,产生白色沉淀,则说明自水中含有Cl-
图①表示向乙酸溶液中通入氨气至过量的过程中溶液导电性的变化 图②表示向1L. l mol·L-1。FeBr2溶液中通入Cl2时Br-物质的量的变化 图③表示向Ca(HCO3)2溶液中滴加NaOH溶液时沉淀质量的变化 图④表示向一定浓度的Na2CO3溶液中滴加盐酸,生成CO2的物质的量与滴加盐酸物质的量的关系
BaCl2溶液 BaCl2溶液、稀盐酸 BaCl2溶液、稀硝酸 BaCl2溶液、稀硫酸
a点:c(H+)=c(Cl-)+c(OH-) b点:c(Cl-)=0.005mol·L-1 c点:c(Na+)=2c(HSO3-)+2c(SO32-)+2c(SO42-)+2c(H2SO3) d 点:c(Na+)>c(Cl-)>2c(SO32-)+C(HSO3-)+2c(SO42-)
pH=7的溶液中可能大量存在Fe3+、Cl-、Na+、S2- 1 mol/L的FeCl3溶液滴入沸水中,得到分散质颗粒数为N.A. 1 mol/L的Fe(NO3)2溶液中滴加盐酸,溶液变为黄色 SO2与FeCl3溶液反应的离子方程式:2Fe3++SO2+4OH-=2Fe2++SO42-+2H2O
0.1 mol/L (NH4)2SO4溶液中的c(NH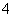 )
)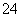 ) 相同温度下,0.6 mol/L氨水溶液和0.3 mol·L-1氨水溶液中c(OH-)之比是2∶1 向0.1 mol/L NaNO3溶液中滴加盐酸使溶液的pH=5,此时混合液中的c(Na+)=c(NO
) 相同温度下,0.6 mol/L氨水溶液和0.3 mol·L-1氨水溶液中c(OH-)之比是2∶1 向0.1 mol/L NaNO3溶液中滴加盐酸使溶液的pH=5,此时混合液中的c(Na+)=c(NO ) 向醋酸钠溶液中加入适量醋酸,使混合液的pH=7,此时混合液中c(Na+)>c(CH3COO-)
) 向醋酸钠溶液中加入适量醋酸,使混合液的pH=7,此时混合液中c(Na+)>c(CH3COO-)
Na2CO3溶液中加盐酸,无气体生成 盐酸中加入Na2CO3溶液,开始无气体,后有气体生成 无论怎么滴加,都有气体生成,且生成的气体一样多 无论怎么滴加,都有气体生成,且盐酸中滴加Na2CO3溶液产生的气体多
①表示Na2CO3溶液中滴入稀盐酸 ②表示溴水中滴入Na2SO3溶液 ③表示AgNO3溶液中滴入氨水 ④表示一定条件下2SO2+O2 2SO3 △H<0达平衡后,升高温度
2SO3 △H<0达平衡后,升高温度
滴加盐酸10.00 mL 时,NH3·H2O. 的电离程度大于 NH4+的水解程度 滴加盐酸 10.00 mL 时,溶液的导电能力与滴加盐酸 30.00mL 时溶液 的导电能力相同 只有滴加盐酸 20.00 mL 时,c(NH4+) + c(H+) = c(Cl-) + c(OH-) 才能成立 滴加盐酸 20.00 mL 时, c(Cl-) > c(NH4+) > c(NH3·H2O) > c(H+) > c(OH-)
向某溶液中加入BaCl2溶液,产生白色沉淀,加入HNO3后,白色沉淀不溶解,也无其他现象,说明原溶液中一定含有SO42— 向某溶液中加盐酸产生无色气体,该气体能使澄清的石灰水变浑浊,说明该溶液中一定含有CO32— 或SO32— 取少量久置的Na2SO3样品于试管中加水溶解,再加盐酸酸化,然后加BaCl2溶液,若加HCl时有气体产生,加BaCl2时有白色沉淀产生,说明Na2SO3样品已部分被氧化 能使湿润的碘化钾淀粉试纸变蓝的一定是Cl2
2molL-1 1.25molL-1 1molL-1 2.5molL-1
0.25mol/L 2mol/L 1mol/L 0.5 mol/L
向Ca(ClO)2溶液中通入CO2至过量 向氢氧化铁胶体中滴加稀硫酸至过量 向Na2SiO3溶液中滴加盐酸溶液至过量 向NaAlO2溶液中滴加盐酸至过量
原NaOH溶液的浓度为0.lmol/L 通入CO2的体积为448mL 所得溶液的溶质成分的物质的量之比为(NaOH)∶(Na2CO3) =1∶3 所得溶液的溶质成分的物质的量之比为(NaHCO3)∶(Na2CO3) =2∶1

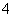 )
)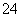 )
)  ) 向醋酸钠溶液中加入适量醋酸,使混合液的pH=7,此时混合液中c(Na+)>c(CH3COO-)
) 向醋酸钠溶液中加入适量醋酸,使混合液的pH=7,此时混合液中c(Na+)>c(CH3COO-)
 2SO3 △H<0达平衡后,升高温度
2SO3 △H<0达平衡后,升高温度