你可能感兴趣的试题
反应前5秒钟内,用NO表示的平均反应速率为0.1 mol·L-1·s-1 达到平衡后,升高温度,正反应速率将减小,逆反应速率将增大 达到平衡后,反应速率的关系有:v正(CO)=2v逆(N2) 保持容器体积不变,往容器中充入1 mol O2,正、逆反应速率都不改变
该反应将能减少汽车尾气对环境的污染 CO是氧化剂 N2发生还原反应 NO2失去电子
用铁片和稀硫酸反应制氢气时,改用98%的硫酸可以加快反应速率 100 mL 2 mol·L.﹣1的盐酸跟锌片反应,加入氯化钠溶液,反应速率不变 SO2的催化氧化反应是一个放热的反应,所以升高温度,反应速率变慢 汽车尾气中的NO和CO可以缓慢反应生成N2和CO2,减小压强反应速率变慢
CO和CO2均具有可燃性 CO和CO2均能与H2O反应 CO和CO2的密度均大于空气的密度 CO和CO2在一定条件下可以相互转化
,向A.溶液中逐滴滴入稀盐酸,加入n(HCl)与生成n(CO2)的关系如图所示,下列有关叙述正确的是 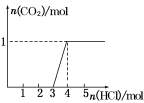 A.通入的CO2气体在标准状况下可能大于22.4L. A.溶液中n(NaOH)=2n(Na2CO3) A.溶液中既含Na2CO3,又含NaHCO3 A.溶液中一定只有Na2CO3
A.通入的CO2气体在标准状况下可能大于22.4L. A.溶液中n(NaOH)=2n(Na2CO3) A.溶液中既含Na2CO3,又含NaHCO3 A.溶液中一定只有Na2CO3
CO2、CO都能用于灭火 二者的组成元素相同,密度也相同 CO2能使澄清石灰水变浑浊,而CO不能 CO还原氧化铁的实验中,不需要进行尾气处理
CO和CO2均具有可燃性 CO和CO2均能与H2O反应 CO和CO2的密度均大于空气的密度 CO和CO2在一定条件下可以相互转化
上述反应中,N2是还原剂,Al2O3是氧化剂 AlN的摩尔质量为41 g AlN中氮元素的化合价为+3 上述反应中,每生成1 mol AlN需转移3 mol电子
浓、稀硝酸都能使蓝色石蕊试纸最终变为红色 硝酸能与Na2CO3反应,但不生成CO2 硝酸可与Na2S反应制得H2S气体 浓硝酸因分解放出的NO2又溶解于硝酸而呈黄色
反应前5秒钟内,用NO表示的平均反应速率为0.1mol/(L·s) 达到平衡后,升高温度,正反应速率将减小,逆反应速率将增大 达到平衡后,反应速率的关系有:v正(CO) = 2v逆(N2) 保持容器体积不变,往容器中充入1molO2,正、逆反应速率都不改变
HNCO中的氮元素被氧化 NO2中的氮元素被还原 每生成1mol H2O转移6mol电子 CO2是氧化产物
CO2、CO都能用于灭火 二者的组成元素相同,密度也相同 CO2能使澄清石灰水变浑浊,而CO不能 CO还原氧化铁的实验中,不需要进行尾气处理
用铁片和稀硫酸反应制氢气时,改用98﹪的硫酸可以加快反应速率 100ml 2mol·L-1 的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变 SO2的催化氧化反应是一个放热的反应,所以升高温度,反应速率变慢 汽车尾气中的NO和CO可以缓慢反应生成N2和CO2,减小压强反应速率变慢。
光反应不需要酶,暗反应需要多种酶 光反应消耗ATP,暗反应形成ATP 光反应固定CO2,暗反应还原CO2 光反应消耗水,暗反应消耗ATP
该反应将能减少汽车尾气对环境的污染 CO是氧化剂 N2发生还原反应 NO2失去电子
上述反应中,N2是还原剂,Al2O3是氧化剂 AlN的摩尔质量为41 g AlN中氮元素的化合价为+3 上述反应中,每生成1 mol AlN需转移3 mol电子
用铁片和稀硫酸反应制氢气时,改用98%的硫酸可以加快反应速率 100 mL 2 mol•L﹣1的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变 SO2的催化氧化反应是一个放热的反应,所以升高温度,反应速率变慢 汽车尾气中的NO和CO可以缓慢反应生成N2和CO2,减小压强反应速率变慢
在其他条件不变时,增加压强,N2的体积分数不变 前5 s内,用CO表示的反应速率等于0.1 mol·L−1·s−1 10 s时密闭容器中压强维持不变 保持容器体积不变,往容器中充入1 mol O2,正、逆反应速率都不改变
CO和CO2均具有可燃性 CO和CO2均能与水反应 CO和CO2的密度均大于空气的密度 CO和CO2在一定的条件下可以互相转化
 A.通入的CO2气体在标准状况下可能大于22.4L. A.溶液中n(NaOH)=2n(Na2CO3) A.溶液中既含Na2CO3,又含NaHCO3 A.溶液中一定只有Na2CO3
A.通入的CO2气体在标准状况下可能大于22.4L. A.溶液中n(NaOH)=2n(Na2CO3) A.溶液中既含Na2CO3,又含NaHCO3 A.溶液中一定只有Na2CO3