你可能感兴趣的试题
放电时,H2SO4浓度增加
放电时,负极的电极反应式为:Pb+SO42﹣﹣2e﹣═PbSO4
在充电时,电池中每转移1 mol电子,理论上生成2 mol硫酸
在充电时,阴极发生的反应是PbSO4﹣2e﹣+2H2O═PbO2+SO42﹣+4H+
放电时,溶液中H+向PbO2电极迁移
放电时,电路中转移0.2mol电子时Pb电极质量减小20.7g
充电时,电解质溶液的pH增大
充电时,阴极的电极反应式为:PbSO4+2H2O-2e-=PbO2+4H++SO42-
工业用电解熔融AlCl3的方法制金属铝 铅蓄电池工作时,正极反应为: PbO2 + 2e- + 4H+ + SO42- = PbSO4 + 2H2O 电解饱和食盐水时,用铁作阳极,Cl- 发生氧化反应 电解精炼铜时,阳极泥中含有Zn、Fe、Ag、Au等金属
需要定期补充硫酸 工作时铅是负极,PbO2是正极 工作时负极上发生的反应是Pb-2e-+SO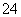 ===PbSO4 工作时电解质的密度减小
===PbSO4 工作时电解质的密度减小
放电时PbO2为正极,反应的离子方程式为:PbO2+4H++2e-+SO42-===PbSO4+2H2O 充电时Pb电极为阴极,反应的离子方程式为:PbSO4+2e-===Pb+SO42- 放电时电解质溶液密度不断减小,可根据电解液密度来判断是否需要充电 充电时可直接使用交流电源,不需要充电器也可充入
放电时正极PbO2和负极Pb均生成PbSO4,并且电解液相对密度变小; 充电时PbSO4正极转变为PbO2,负极转变为Pb,并且电解液相对密度变小; 充电时PbSO4正极转变为Pb,负极转变为PbO2,并且电解液相对密度变小 放电时负极PbO2和正极Pb均生成PbSO4,并且电解液相对密度变小;
PbO2 /Pb PbO2 /PbO2 PbO2/PbSO4 PbSO4/PbSO4
放电时,该电池的正极材料是硫酸铅 充电时,阳极反应是:PbSO4-2e-+2H2O=PbO2+SO +4H+ 充电时,电池中硫酸的浓度不断减小 放电时,正极反应是:Pb-2e-+SO
+4H+ 充电时,电池中硫酸的浓度不断减小 放电时,正极反应是:Pb-2e-+SO =PbSO4
=PbSO4
放电时:当外电路通过1mol的电子时,理论上负极板的质世增加了151.5g 充电时:阳极反应是PbSO4→2e-+2 H2O =PbO2+ SO42-+4H+ 放电时:正极反应是Pb-2e-+ SO42-= PbSO4 充电时:铅蓄电池的阴极应与电源的正极相连
Pb为正极,PbO2为负极 正极电极反应式为PbO2 + SO4 2- + 2H+ == PbSO4 + H2O 硫酸溶液中,H+移向负极 放电一段时间后,SO4 2-浓度减小
PbSO4/Pb3O4 3PbSO3/Pb3O4 3Pb/Pb3O4 Pb3O4/3PbSO4 Pb3O4/PbSO4
Pb为正极,被氧化 溶液的pH不断减小 SO42-只向PbO2处移动 电解液密度不断减小

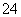 ===PbSO4 工作时电解质的密度减小
===PbSO4 工作时电解质的密度减小
 +4H+ 充电时,电池中硫酸的浓度不断减小 放电时,正极反应是:Pb-2e-+SO
+4H+ 充电时,电池中硫酸的浓度不断减小 放电时,正极反应是:Pb-2e-+SO =PbSO4
=PbSO4