你可能感兴趣的试题
室温下,测0.1mol/L HX溶液的pH,若pH>1,证明HX是弱酸 室温下,测1mol/L NaX溶液的pH,若pH>7,证明HX是弱酸 将等浓度、等体积的HCl和NaX溶液混合,若混合溶液pH<7,证明HX是弱酸 在相同条件下,对0.1 mol/L的HCl和0.1mol/L的HX进行导电性实验,若HX溶液灯泡较暗,证明HX为弱酸
室温下,测0.1mol/L HX溶液的pH ,若pH>1,证明HX是弱酸 室温下,测1mol/L NaX溶液的pH ,若pH>7,证明HX是弱酸 将等浓度、等体积HCl和NaX溶液混合,若混合溶液pH<7,证明HX是弱酸 在相同条件下,对0.1 mol/L的盐酸和0.1mol/L的HX溶液进行导电性实验,两者相比较HX溶液灯泡相对较暗,证明HX为弱酸
HX>HY>HZ HX>HZ>HY HZ>HY>HX HY>HX>HZ
CO2溶于水形成碳酸,SiO2难溶于水 CO2通入可溶性硅酸盐中析出硅酸沉淀 高温下SiO2与碳酸盐反应生成CO2 氯化氢通入可溶性硅酸盐溶液中生成沉淀
若a=b,则m+n<14 若a=b,则HX一定是弱酸 反应后溶液中一定存在c(Na+)>c(X-)>c(OH-)>c(H+) 若a=2b,则反应后溶液中一定存在2c(OH-)=c(HX)+2c(H+)
HX可能是强酸 HX的酸性比HY的酸性弱 两酸的浓度大小[HX]<[HY] pH=1的两种一元酸均稀释100倍,稀释后两溶液的pH均为3
 和
和 溶液中:
溶液中: 一元弱碱MOH对应的盐MCl溶液中:
一元弱碱MOH对应的盐MCl溶液中: 等物质的量的一元弱酸HX与其钾盐KX的混合溶液中:
等物质的量的一元弱酸HX与其钾盐KX的混合溶液中: pH=3的一元酸HX和pH=11的一元碱MOH等体积混合:
pH=3的一元酸HX和pH=11的一元碱MOH等体积混合: 
从甲组情况分析,若a=7,则HX为强酸;若a>7,则HX为弱酸 在乙组混合溶液中,离子浓度c(X-)=c(Na+) 从丙组实验结果分析,HX是弱酸 丁组实验所得混合溶液中,由水电离出的c(OH-)=10-10 mol/L
HR溶液中滴加紫色石蕊试液,溶液变红色 室温时,NaR溶液的pH大于7 HR溶液加入少量NaR固体,溶解后溶液的pH变大 室温时,0.01 mol·L-1的HR溶液pH=4
HX可能是强酸 NaX水溶液的碱性弱于NaY水溶液的碱性 HX一定是弱酸 反应过程中二者生成H2的速率相同
Na2CO3和NaHCO3溶液中: c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-) 一元弱碱MOH对应的盐MCl溶液中: c(Cl-)>c(H+)>c(M+)>c(OH-) 等物质的量的一元弱酸HX与其钾盐KX的混合溶液中: 2c(K+)=c(X-)+c(HX) pH=3的一元酸HX和pH=11的一元碱MOH等体积混合: c(M+)=c(X-)>c(H+)=c(OH-)
若HX是弱酸,YOH是强碱,则两溶液浓度相等 若HX是强酸,YOH是弱碱,则两溶液体积相等 若HX是弱酸,YOH是强碱,则两溶液体积一定是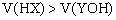 在混合后的中性溶液中,
在混合后的中性溶液中,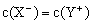
相同条件下HA溶液的导电性弱于盐酸 0.1mol/L的HA溶液pH为3 HA溶液中滴加石蕊显红色 NaA溶液显碱性
pH=7 [A-]>[B-] [OH-]=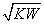 [H+]-[OH-]=[A-]-[B+]
[H+]-[OH-]=[A-]-[B+]

 和
和 溶液中:
溶液中: 一元弱碱MOH对应的盐MCl溶液中:
一元弱碱MOH对应的盐MCl溶液中: 等物质的量的一元弱酸HX与其钾盐KX的混合溶液中:
等物质的量的一元弱酸HX与其钾盐KX的混合溶液中: pH=3的一元酸HX和pH=11的一元碱MOH等体积混合:
pH=3的一元酸HX和pH=11的一元碱MOH等体积混合: 
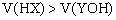 在混合后的中性溶液中,
在混合后的中性溶液中,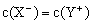
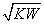 [H+]-[OH-]=[A-]-[B+]
[H+]-[OH-]=[A-]-[B+]