你可能感兴趣的试题
若混合后所得溶液呈中性,则HA肯定是强酸、BOH肯定是强碱 若混合前酸、碱物质的量浓度相同,混合后所得溶液呈酸性,则HA肯定是弱酸 若混合前酸、碱pH之和等于14,混合后所得溶液呈碱性,则BOH肯定是弱碱 若混合后所得溶液呈酸性,则混合溶液中离子浓度一定满足: 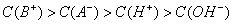
在pH=11的溶液中,水电离出的c(OH一)一定等于10-11mol/L 将pH=l的酸和pH=13的碱溶液等体积混合后,溶液的pH一定等于7 将物质的量浓度和体积都相同的一元酸HA与一元碱BOH混合后,溶液呈中性,则反应后溶液中c(H+)= 若强酸、强碱中和后溶液pH=7,则中和前酸、碱的pH之和一定等于14
若强酸、强碱中和后溶液pH=7,则中和前酸、碱的pH之和一定等于14
若混合前酸、碱pH之和等于14,则HA一定是弱酸 若混合前酸、碱物质的量浓度相同,则BOH一定是弱碱 溶液中水的电离程度:混合溶液>纯水>BOH溶液 混合溶液中离子浓度一定满足:c(B+)>c(A-)>c(H+)>c(OH-)
混合溶液中, 混合溶液的PH = 7 a = b 混合溶液中,c(B+)+c(H+)=c(A-) +c(OH-)
混合溶液的PH = 7 a = b 混合溶液中,c(B+)+c(H+)=c(A-) +c(OH-)
①溶液中:c(A-)>c(Na+)>c(OH-)>c(H+) ①溶液中:c(HA)+c(A-)=0.1mol/L 常温下,0.1mol/LHA溶液的pH=1 0.1mol/LHA溶液中:c(HA)>c(A-)
实验①反应后的溶液中:c(K+) > c(A-) > c(OH-) > c(H+) 实验①反应后的溶液中:c(OH-) = c(K+) — c(A-) =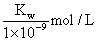 实验②反应后的溶液中:c(A-) + c(HA) > 0.1mol/L 实验②反应后的溶液中:c(K+) = c(A-) > c(OH-) = c(H+)
实验②反应后的溶液中:c(A-) + c(HA) > 0.1mol/L 实验②反应后的溶液中:c(K+) = c(A-) > c(OH-) = c(H+)
该溶液中HA有0.1%发生了电离 此酸电离平衡常数约为10-7 升高温度后溶液的PH增大 若将PH=2的HA溶液与PH=12的NaOH溶液等体积混合后PH=7
实验①反应后的溶液中:c(OH-)=c(K+)-c(A-)= mol/L 实验①反应后的溶液中:c(K+)>c(A-)>c(OH-)>c(H+) 实验②反应后的溶液中:c(A-)+c(HA)>0.1 mol/L 实验②反应后的溶液中:c(K+)=c(A-)>c(OH-)=c(H+)
mol/L 实验①反应后的溶液中:c(K+)>c(A-)>c(OH-)>c(H+) 实验②反应后的溶液中:c(A-)+c(HA)>0.1 mol/L 实验②反应后的溶液中:c(K+)=c(A-)>c(OH-)=c(H+)
该溶液中HA有0.1%发生了电离 此酸电离平衡常数约为10﹣7 升高温度后溶液的PH增大 若将PH=2的HA溶液与PH=12的NaOH溶液等体积混合后PH=7
若V1>V2,则说明HA的酸性比HB的酸性强 若V1>V2,则说明HA的酸性比HB的酸性弱 因为两种酸溶液的pH相等,故V1一定等于V2 若将两种酸溶液等体积混合,混合酸溶液的pH一定等于2
实验①反应后的溶液中: 实验①反应后的溶液中:
实验①反应后的溶液中: 实验②反应后的溶液中:
实验②反应后的溶液中: 实验②反应后的溶液中:
实验②反应后的溶液中:
若混合前酸、碱溶液的pH之和等于14,则HA是强酸
若酸、碱溶液的物质的量浓度相等,则BOH是弱碱
水的电离程度:混合溶液>纯水>BOH溶液
混合后溶液中的离子浓度关系:c(B+)>c(A-)>c(H+)>c(OH-)
若混合前酸、碱物质的量浓度相同,则HA肯定是弱酸 溶液中水的电离程度:混合溶液>纯水>BOH溶液 若混合前酸、碱pH之和等于14,则HA肯定是弱酸 混合溶液中离子浓度一定满足:c(B+)>c(A-)>c(H+)>c(OH-)
中和一定的NaOH溶液,需消耗与NaOH等物质的量的HA
将pH=4的HA溶液稀释10倍,溶液pH小于5
将pH=2的HA溶液与pH=12的NaOH溶液等体积混合后,溶液呈酸性
将0.1mol/L的HA溶液与0.1 mol/L的NaOH溶液等体积混合后,溶液呈碱性
若V1>V2,则说明HA的酸性比HB的酸性强
若V1>V2,则说明HA的酸性比HB的酸性弱
因为两种酸溶液的pH相等,故V1一定等于V2
若将两种酸溶液等体积混合,混合溶液的pH一定等于2
a=b 混合溶液的pH= 7 混合溶液中,c(H+) =  mol/L 向反应后的混合液中滴加石蕊试液后呈紫色
mol/L 向反应后的混合液中滴加石蕊试液后呈紫色

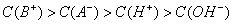
 若强酸、强碱中和后溶液pH=7,则中和前酸、碱的pH之和一定等于14
若强酸、强碱中和后溶液pH=7,则中和前酸、碱的pH之和一定等于14
 混合溶液的PH = 7 a = b 混合溶液中,c(B+)+c(H+)=c(A-) +c(OH-)
混合溶液的PH = 7 a = b 混合溶液中,c(B+)+c(H+)=c(A-) +c(OH-)
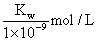 实验②反应后的溶液中:c(A-) + c(HA) > 0.1mol/L 实验②反应后的溶液中:c(K+) = c(A-) > c(OH-) = c(H+)
实验②反应后的溶液中:c(A-) + c(HA) > 0.1mol/L 实验②反应后的溶液中:c(K+) = c(A-) > c(OH-) = c(H+)
 mol/L 实验①反应后的溶液中:c(K+)>c(A-)>c(OH-)>c(H+) 实验②反应后的溶液中:c(A-)+c(HA)>0.1 mol/L 实验②反应后的溶液中:c(K+)=c(A-)>c(OH-)=c(H+)
mol/L 实验①反应后的溶液中:c(K+)>c(A-)>c(OH-)>c(H+) 实验②反应后的溶液中:c(A-)+c(HA)>0.1 mol/L 实验②反应后的溶液中:c(K+)=c(A-)>c(OH-)=c(H+)
 实验①反应后的溶液中:
实验①反应后的溶液中: 实验②反应后的溶液中:
实验②反应后的溶液中: 实验②反应后的溶液中:
实验②反应后的溶液中:
 mol/L 向反应后的混合液中滴加石蕊试液后呈紫色
mol/L 向反应后的混合液中滴加石蕊试液后呈紫色