你可能感兴趣的试题
B.C.三种气体,保持一定温度,在t1~t4时刻测得各物质的浓度如下表。据此判断下列结论正确的是( ) A.在t3时刻反应已经停止 A.的转化率比B.的转化率低 在容器中发生的反应为:2A+B.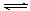 2C 在t2~t3内A.的平均反应速率为:[1/(t3-t2)] mol·L.-1·s-1
2C 在t2~t3内A.的平均反应速率为:[1/(t3-t2)] mol·L.-1·s-1
B.C.三种气体,保持一定温度,在t1~t4(s)时刻测得各物质的浓度如下表。据此下列结论正确的是( )A.在t3时刻反应已经停止 A.的转化率比B.的转化率低 在容器中发生的反应为:2A+B  2C 在t2~t3内A.的平均反应速率为[1/(t3-t2)]mol/(L·s)
2C 在t2~t3内A.的平均反应速率为[1/(t3-t2)]mol/(L·s)
B.C.三种气体,保持一定温度,在t1~t4时刻测得各物质的浓度如下表。据此判断下列结论正确的是( )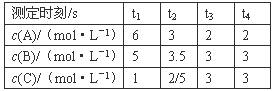 A.在t3时刻反应已经停止 A.的转化率比B.的转化率低 在容器中发生的反应为: 2A+B
A.在t3时刻反应已经停止 A.的转化率比B.的转化率低 在容器中发生的反应为: 2A+B  2C 在t2~t3内A.的平均反应速率为:[1/(t3-t2)]mol・L.-1・s-1
2C 在t2~t3内A.的平均反应速率为:[1/(t3-t2)]mol・L.-1・s-1
容器内压强不随时间变化 容器内X.、Y.、Z.的浓度之比为1︰2︰2 容器内气体的密度不变 单位时间消耗0.1molX.同时生成0.2molZ.
保持容器容积不变,向其中加入1molH2,化学反应速率不变 保持容器容积不变,向其中加入1molAr,化学反应速率增大 保持容器内气体压强不变,向其中加入1molAr,化学反应速率不变 保持容器内气体压强不变,向其中加入1 mol H2(g)和1molI2(g),化学反应速率不变
B.C.三种气体,保持一定温度,在t1~t4时刻测得A. C.三种物质的物质的量如下表。据此判断下列结论中不正确的是( ) A.在容器中发生的反应为:2A+B C B.平衡时A.的转化率比B.的转化率高 在该温度下该反应的化学平衡常数K.=200 在t1~t2内C.物质的平均反应速率为[2/(t2 -t1)]mol/(L·s)
C B.平衡时A.的转化率比B.的转化率高 在该温度下该反应的化学平衡常数K.=200 在t1~t2内C.物质的平均反应速率为[2/(t2 -t1)]mol/(L·s)
容器内压强不随时间变化 容器内各物质的浓度不随时间变化 容器内X.、Y.、Z.的浓度之比为1∶2∶2 单位时间消耗0.1 molX.同时消耗0.2 molZ.
B.C.三种气体,保持一定温度,在t1~t4 s时测得各物质的浓度如表,则下列判断正确的是( ) A.在t3 s时反应已经停止 t3~t4 s内正、逆反应速率不相等 在容器中发生的反应为A.(g)+B.(g) ⇌C(g) 在t2~t3 s内A.的平均反应速率为 mol/(L·s)
mol/(L·s)
若容器内气体的密度不再发生变化,则说明反应达到平衡状态 若t1=20 s,则从t0~t1内的平均反应速率v(NH3)=0.01 mol·L-1·s-1 图2中,t2时改变的条件是降低温度,t3时改变的条件是增大压强 若t2时,再向容器中加入1.4 mol NH3、0.8 mol H2,则平衡将正向移动
B.C.三种气体,保持温度一定,在t1~t4时刻测得各物质的浓度如下表。据此判断下列结论正确的是 A.在t3时刻反应已经停止 A.的转化率比B.的转化率低 该温度下此可逆反应平衡常数K.=4 该反应的化学方程式为2A(g)+B.(g) C.(g)
C.(g)
和3 mol ,在一定温度下发生反应:A.(g)+B(g)  (g)+D(g),下列可作判断反应是否达到平衡的依据的是( ) A.气体的密度是否变化 B.容器内的压强是否变化 C.容器中A.的浓度是否变化 容器中C.D.的物质的量之比是否变化
(g)+D(g),下列可作判断反应是否达到平衡的依据的是( ) A.气体的密度是否变化 B.容器内的压强是否变化 C.容器中A.的浓度是否变化 容器中C.D.的物质的量之比是否变化
容器内压强不随时间变化 容器内气体的密度不随时间变化 容器内X.、Y.、Z.的浓度之比为1︰2︰2 单位时间消耗0.1molX.同时生成0.2molZ.
容器内压强不随时间变化 容器内各物质的浓度不变 容器内X.、Y.、Z.的浓度之比为1︰2︰2 单位时间消耗0.1molX同时生成0.2molZ
B.C.三种气体,保持一定温度,在t1~t4时刻测得各物质的浓度如下表。据此判断下列结论正确的是( ) A.在t3 时刻反应已经停止 A.的转化率比B.的转化率低 在容器中发生的反应为2A+B. 2C 在t2~t3内A.的平均反应速率为[1/(t3-t2)]mol·L-1·s-1
2C 在t2~t3内A.的平均反应速率为[1/(t3-t2)]mol·L-1·s-1

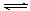 2C 在t2~t3内A.的平均反应速率为:[1/(t3-t2)] mol·L.-1·s-1
2C 在t2~t3内A.的平均反应速率为:[1/(t3-t2)] mol·L.-1·s-1
 2C 在t2~t3内A.的平均反应速率为[1/(t3-t2)]mol/(L·s)
2C 在t2~t3内A.的平均反应速率为[1/(t3-t2)]mol/(L·s)
 A.在t3时刻反应已经停止 A.的转化率比B.的转化率低 在容器中发生的反应为: 2A+B
A.在t3时刻反应已经停止 A.的转化率比B.的转化率低 在容器中发生的反应为: 2A+B  2C 在t2~t3内A.的平均反应速率为:[1/(t3-t2)]mol・L.-1・s-1
2C 在t2~t3内A.的平均反应速率为:[1/(t3-t2)]mol・L.-1・s-1
 C B.平衡时A.的转化率比B.的转化率高 在该温度下该反应的化学平衡常数K.=200 在t1~t2内C.物质的平均反应速率为[2/(t2 -t1)]mol/(L·s)
C B.平衡时A.的转化率比B.的转化率高 在该温度下该反应的化学平衡常数K.=200 在t1~t2内C.物质的平均反应速率为[2/(t2 -t1)]mol/(L·s)
 mol/(L·s)
mol/(L·s)
 C.(g)
C.(g)
 (g)+D(g),下列可作判断反应是否达到平衡的依据的是( ) A.气体的密度是否变化 B.容器内的压强是否变化 C.容器中A.的浓度是否变化 容器中C.D.的物质的量之比是否变化
(g)+D(g),下列可作判断反应是否达到平衡的依据的是( ) A.气体的密度是否变化 B.容器内的压强是否变化 C.容器中A.的浓度是否变化 容器中C.D.的物质的量之比是否变化
 2C 在t2~t3内A.的平均反应速率为[1/(t3-t2)]mol·L-1·s-1
2C 在t2~t3内A.的平均反应速率为[1/(t3-t2)]mol·L-1·s-1