你可能感兴趣的试题
常温下,等浓度、等体积的NaHCO3 溶液pH小于 溶液pH 常温下,等浓度、等体积的Na2 CO3 溶液和
溶液pH 常温下,等浓度、等体积的Na2 CO3 溶液和  溶液中所含离子总数前者小于后者
溶液中所含离子总数前者小于后者  水杨酸的第二级电离 Ka2 远小于第一级电离Ka1 的原因之一是 能形成分子内氢键
水杨酸的第二级电离 Ka2 远小于第一级电离Ka1 的原因之一是 能形成分子内氢键
常温下,某难溶物的Ksp为2.5×105 反应2Mg(s)+CO2(g)= (s)+2MgO(s)能自发进行,则该反应的△H < 0 C.NH3•H2O溶液加水稀释后,溶液中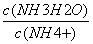 的值减小 常温下,pH均为5的盐酸与氯化铵溶液中,水的电离程度相同
的值减小 常温下,pH均为5的盐酸与氯化铵溶液中,水的电离程度相同
0.1 mol•L-1NaHCO3溶液: K+、Fe3+、Cl-、NO3- 使甲基橙变红色的溶液:NH4+、Cu2+、ClO-、Na+ 常温下由水电离出的c(H+)=1×10-13mol·L-1的溶液中:Mg2+、Na+、SO32-、NO3- 常温下在c(H+)=1×10-13mol·L-1的溶液中: Na+、K+、SO42-、CO32-
常温下,测得醋酸钠溶液的pH>7 常温下,测得0.1mol/L醋酸溶液的pH=4 常温下,将pH=1的醋酸溶液稀释1000倍,测得pH<4 常温下,将物质的量浓度相同的醋酸溶液与氢氧化钠溶液等体积混合后恰好中和
常温下,pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,水的电离程度相同 常温下,反应 (s)+CO2(g)=2CO(g)不能自发进行,则该反应的ΔH<0 C.常温下,将pH =10的氨水稀释后,溶液中所有离子浓度都减小 常温下,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大
常温下,HA的电离常数K(HA)约为10-5 v1<20 溶液中水的电离程度:a点>b点 滴定过程为了确定滴定终点,最合适的指示剂是酚酞
常温下,等浓度、等体积的NaHCO3 溶液pH小于 溶液pH 常温下,等浓度、等体积的Na2 CO3 溶液和
溶液pH 常温下,等浓度、等体积的Na2 CO3 溶液和 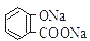 溶液中所含离子总数前者小于后者
溶液中所含离子总数前者小于后者 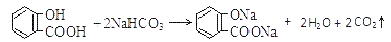 水杨酸的第二级电离 Ka2 远小于第一级电离Ka1 的原因之一是 能形成分子内氢键
水杨酸的第二级电离 Ka2 远小于第一级电离Ka1 的原因之一是 能形成分子内氢键
常温下的红宝石激光器 氦氖激光器 Nd:YAG 常温下的掺铒光纤
该溶液可由等体积、浓度均为0.1mol·L.‾1的醋酸和氨水反应得到 CH3COONH4加入纯水中,水的电离程度不变 常温下,电离常数K.(CH3COOH)=K.(NH3·H2O) 该溶液中c(CH3COO‾)大于同浓度CH3COONa溶液中的c(CH3COO‾)
常温下,NO分解产生O2的反应平衡常数表达式为K1=[N2][O2] 常温下,水分解产生O2,此时平衡常数的数值约为5×10﹣80 常温下,NO、H2O、CO2三种化合物分解放出O2的倾向由大到小的顺序为NO>H2O>CO2 以上说法都不正确
碳酸的酸性强于氢硫酸 多元弱酸的酸性主要由第一步电离决定 多元弱酸的各步电离之间无影响 向弱酸溶液中加少量NaOH固体,电离常数不变
常温下,pH相同的NaOH溶液和Ba(OH)2溶液中,水的电离程度相同 常温下,将pH=3的硫酸和pH=11的氨水等体积混合后,所得溶液的pH>7 常温下,将醋酸溶液与NaOH 溶液等体积混合后,若所得溶液的pH=7,则原溶液中c(CH3COOH)>c(NaOH) 常温下,pH=1的NaHSO4溶液:c(H+)=2c(SO42-)+c(OH-)
五种物质在常温下溶解度最小的是Ag2S 向AgCl悬浊液中加入Na2S,则可以生成黑色沉淀 氯化银、溴化银和碘化银三种物质在常温下的溶解度依次增大 难溶电解质的溶解平衡的建立是有条件的,外界条件改变时,平衡也会发生移动
常温下,pH等于14与pH等于12的两种NaOH溶液等体积混合后, c(H+)=(10-14+10-10)/2 常温下,浓度为1×10-10 mol·L.-1的KOH溶液的pH为7 氨水加水稀释,溶液中除水以外的所有粒子的浓度都减小 常温下,pH等于1的盐酸溶液中水的电离程度与pH等于13的Ba(OH)2溶液中水的电离程度相等

 溶液pH 常温下,等浓度、等体积的Na2 CO3 溶液和
溶液pH 常温下,等浓度、等体积的Na2 CO3 溶液和  溶液中所含离子总数前者小于后者
溶液中所含离子总数前者小于后者  水杨酸的第二级电离 Ka2 远小于第一级电离Ka1 的原因之一是 能形成分子内氢键
水杨酸的第二级电离 Ka2 远小于第一级电离Ka1 的原因之一是 能形成分子内氢键
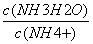 的值减小 常温下,pH均为5的盐酸与氯化铵溶液中,水的电离程度相同
的值减小 常温下,pH均为5的盐酸与氯化铵溶液中,水的电离程度相同
 溶液pH 常温下,等浓度、等体积的Na2 CO3 溶液和
溶液pH 常温下,等浓度、等体积的Na2 CO3 溶液和 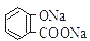 溶液中所含离子总数前者小于后者
溶液中所含离子总数前者小于后者 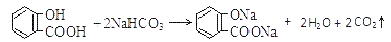 水杨酸的第二级电离 Ka2 远小于第一级电离Ka1 的原因之一是 能形成分子内氢键
水杨酸的第二级电离 Ka2 远小于第一级电离Ka1 的原因之一是 能形成分子内氢键