你可能感兴趣的试题
三种物质的溶解度大小顺序为:甲>乙>丙; 30℃时,三种物质的饱和溶液中溶质的质量分数:甲>乙>丙; 降低温度可使丙的不饱和溶液变成饱和溶液; 三种物质的溶解度都随温度升高而增大。
a物质的溶解度随温度升高而增大 30℃时,b物质的溶解度为20g t℃时,a、b的饱和溶液溶质质量分数相等 30℃时,b物质饱和溶液的溶质质量分数为20% 
10℃时,将40g NaCl固体加入l00g水中,可得到l40gNaCl溶液 KNO3和NaCl的溶解度受温度的影响都很大 将30℃的KNO3饱和溶液升温至60℃,会变成不饱和溶液 20℃时,NaCl饱和溶液的溶质质量分数为36%
甲物质的溶解度大于乙物质的溶解度 t1℃时,甲、乙两物质的溶解度相等,均为40g t2℃时,甲溶液的溶质质量分数一定大于乙溶液的溶质 质量分数 甲的溶解度受温度影响较小
甲的溶解度大于乙的溶解度 30℃时,甲、乙两种物质的饱和溶液中溶质的质量分数相等 使乙物质从它的一定温度下的饱和溶液中析出,一般采用冷却的方法 升高温度可使甲的不饱和溶液转变为饱和溶液
溶解度能够表示物质溶解性的强弱程度 溶解度能够表示溶质在溶剂中溶解的程度 溶解度能够表示某种物质在某种溶剂中的溶解限量 在相同温度、相同溶剂的条件下,要判定不同物质的溶解度相对大小,可以根据其饱和溶液的溶质质量分数
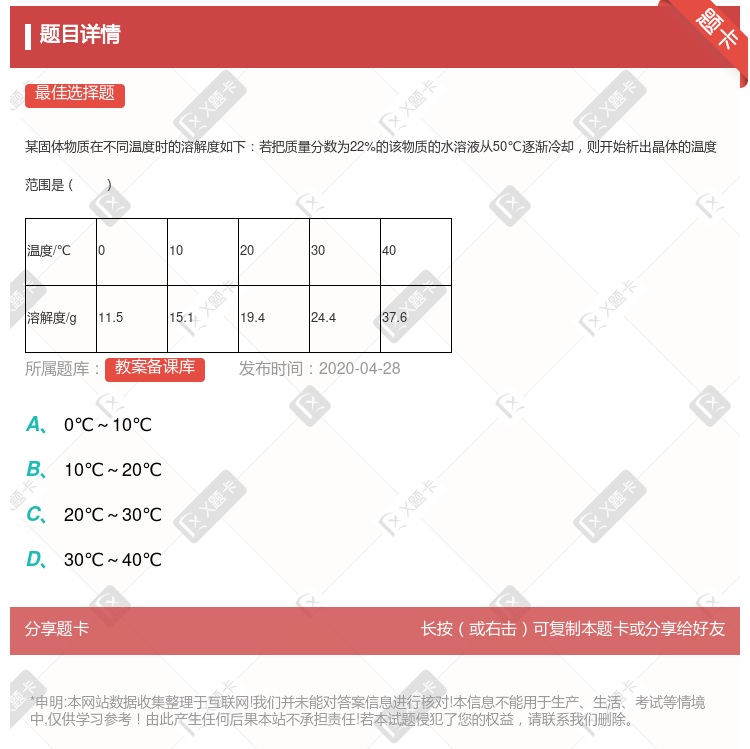
0℃—10℃ 10℃—20℃ 20℃—30℃ 30℃—40℃
该硝酸钾样品为纯净物 40 ℃时溶于水的硝酸钾为130 g 70 ℃时KNO3溶液为饱和溶液 55 ℃左右时KNO3完全溶解
0~10℃ 10℃~20℃
20℃~30℃ 30℃~40℃
0 ℃-10 ℃ 10 ℃-20 ℃ 20 ℃-30 ℃ 30 ℃-40 ℃
KNO3的溶解度大于KCl的溶解度 两物质溶解度相等的温度在10-20℃之间 在30℃时,5gKN03加入到10 g水中 可得到33.3%的KN03溶液 在50℃时,两物质各10g分别加入20g水中,充分溶解,只有KCl中有固体剩余
溶解度能够表示物质溶解性的强弱程度 溶解度能够表示溶质在溶剂中溶解的程度 溶解度能够表示某种物质在某种溶剂中的溶解限量 在相同温度、相同溶剂的条件下,要判定不同物质的溶解度相对大小,可以根据其饱 和溶液的溶质质量分数
甲的溶解度大于乙的溶解度 降低温度可能使甲的不饱和溶液转变为饱和溶液 使乙物质从它的一定温度下的饱和溶液中析出,一般采用降温结晶的方法 30℃时,甲、乙两种物质的溶液中溶质的质量分数相等
0℃~10℃ 10℃~20℃ 20℃~30℃ 30℃~40℃
物质C.的溶解度随温度的升高而减小 t2℃时,物质a的饱和溶液溶质的质量分数为50% 温度高于t1℃时物质a的溶解度大于物质c的溶解度 将t2℃时物质b的饱和溶液降温至t1℃时溶质的质量分数会减小 
甲物质的溶解度大于乙物质的溶解度 t1℃时,甲、乙两物质的溶解度相等,均为40g t2℃时,甲溶液的溶质质量分数一定大于乙溶液的溶质 质量分数  甲的溶解度受温度影响较小
甲的溶解度受温度影响较小
溶解度能够表示物质溶解性的强弱程度 溶解度能够表示溶质在溶剂中溶解的程度 溶解度能够表示某种物质在某种溶剂中的溶解限量 在相同温度、相同溶剂的条件下,要判定不同物质的溶解度相对大小,可以根据其饱和溶液的溶质质量分数
KCl固体的溶解度随温度的升高而增大 80℃时,KCl固体的溶解度是51.1g 60℃的KCl饱和溶液降温后会有晶体析出 20℃时,KCl饱和溶液的溶质质量分数为34.0%
20℃时该物质的溶解度为40 d点对应溶液的溶质质量分数为20% 该物质的溶解度随温度的升高而增大 a~d点对应溶液的溶质质量分数关系是:d<c<a = b


 甲的溶解度受温度影响较小
甲的溶解度受温度影响较小