你可能感兴趣的试题
逆反应速率不变 正反应速率降低 速率常数变小 平衡常数变大
改变压强引起了反应物浓度的改变,改变压强才对化学反应速率产生影响 固体或纯液体的浓度是常数1 mol/L 改变反应物浓度,只对不可逆反应的化学反应速率才产生影响 改变反应物浓度,对逆反应的化学反应速率无影响
可逆反应的特征是正反应速率和逆反应速率相等 在其它条件不变时,升高温度可以使化学平衡向放热反应的方向移动 在其它条件不变时,增大压强一定会破坏气体反应的平衡状态 在其它条件不变时,使用催化剂可改变化学反应速率,但不能改变化学平衡状态
反应温度升高,正,逆反应速率均增加 对吸热反应,温度升高使平衡向右移动 对放热反应,温度升高使平衡常数增加 温度升高使速率常数增加
物质发生化学反应都伴随着能量变化 化学反应的速率和限度均可通过改变化学反应条件而改变 可逆反应只是代表少数反应 化学反应达到平衡状态时,正反应速率与逆反应速率相等
可逆反应的特征是正反应速率和逆反应速率相等 在其它条件不变时,使用催化剂只能改变反应速率,而不能改变化学平衡状态 在其它条件不变时,升高温度可以使平衡向放热反应方向移动 在其它条件不变时,增大压强一定会破坏气体反应的平衡状态
平衡常数变小 反应速率增大 反应速率降低 速率常数变小
反应的速率 反应的平衡常数 反应速率常数 反应的活化能
温度变化相同时,活化能较大的反应,速率常数变化也较大; 低温区温度改变对速率的影响比高温区大; 相同的温度变化,对级数较高的反应速率影响较大; 温度一定时,活化能较大的反应速率常数较小。
可逆反应的特征是正反应速率总是和逆反应速率相等。 在其它条件不变时,使用催化剂只能改变反应速率,而不能改变化学平衡状态。 在其它条件不变时,升高温度可以使化学平衡向吸热反应的方向移动。 在其它条件不变时,增大压强一定会破坏气体反应的平衡状态。
改变外界条件不能改变化学反应速率 当某反应在一定条件下达到反应限度时即达到了化学平衡状态 当某反应体系中气体的压强不再改变时,该反应一定达到反应限度 当某反应达到限度时,反应物和生成物的浓度一定相等
可逆反应的特征是正反应速率总是和逆反应速率相等 在其他条件不变时,使用催化剂只能改变反应速率,而不能改变化学平衡状态 在其他条件不变时,升高温度可以使化学平衡向放热反应的方向移动 在其他条件不变时,增大压强一定会破坏气体反应的平衡状态
正反应速率 化学平衡常数 反应速率常数 反应活化能
对于任何化学反应来说,反应速率越大,反应现象就越明显 在其他条件不变时,升高温度一定会加快化学反应的反应速率 使用合理的催化剂,可以改变化学反应速率,但不能改变化学平衡状态 增大反应物浓度,可使单位体积内活化分子数增加,反应速率加快
t0时条件改变引起的变化是平衡向正反应方向移动 若t0改变的条件是压强,则W.、Z.均为气体,X.、Y.中只有一种为气体 若t0改变的条件是温度,则该反应的正反应是吸热反应 若t0改变的条件是浓度,改变的方法是减小X.、Y.的浓度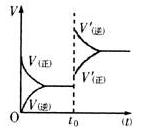
可逆反应的特征是正反应速率和逆反应速率为零 在其他条件不变时,使用催化剂只能改变反应速率,而不能改变化学平衡状态 在其他条件不变时,升高温度可以使平衡向放热反应方向移动 在其他条件不变时,增大压强一定会破坏气体反应的平衡状态

