你可能感兴趣的试题
BrO3^-+5Br^-+6H^+=3Br2+3H2O 3Cl2+6KOH=5KCl+KClO3+3H2O 2AgNO3=2Ag+2NO2+O2↑ KClO3+6HCI 浓=3Cl2↑+KCl+3H2O
反应生成物都属于电解质 HCl全部发生氧化反应 该反应表明氧化性KClO3比Cl2强 1mol KClO3在反应中得到6mole-
氧化性由强到弱的顺序为:KBrO3>KClO3>Cl2>Br2 ①中KCl是氧化产物,KBr发生还原反应 ③中1 mol氧化剂参加反应得到电子的物质的量为2 mol 反应②中氧化剂与还原剂的物质的量之比为1∶6
2Na218O2 + 2H2O == 4Nal8OH + O2↑ NaH+D.2O===NaOH+D.2↑ 2KMnO4 + 5H218O2 + 3H2SO4 == K2SO4 + 2MnSO4 + 518O2↑+ 8H2O K37ClO3 + 6HCl == K37Cl + 3Cl2↑+ 3H2O
上述三个反应都有单质生产,所以都是置换反应 氧化性由强到弱的顺序为KBrO3 >KClO3 >Cl2 >Br2 反应①中还原剂与氧化剂的物质的量之比为6:1 若反应②中有1 mol还原剂参加反应,则氧化剂得电子的物质的量为2 mol
上述三个反应都有单质生成,所以都是置换反应 氧化性由强到弱顺序为 KBrO3>KClO3>Cl2>Br2 反应②中还原剂与氧化剂的物质的量之比为6 :1 ③中lmol还原剂反应则氧化剂失去电子的物质的量为10mol
BrO3^-+5Br^-+6H^+=3Br2+3H2O 3Cl2+6KOH=5KCl+KClO³+3H2O 2AgNO3=2Ag+2NO2+O2↑ KClO3+6HCI 浓=3Cl2↑+KCl+3H2O
上述三个反应都有单质生成,所以都是置换反应 反应②中还原剂与氧化剂的物质的量之比为6:1 反应③中1mol Cl2反应,则氧化剂得电子的物质的量为10mol 氧化性由强到弱的顺序为:KClO3>KBrO3>Cl2>Br2
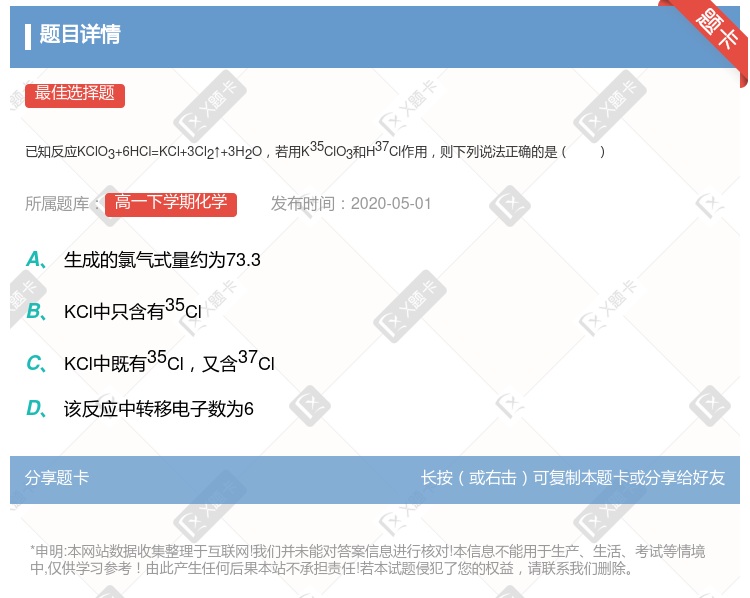
Cl2相对分子质量约为73.3 该反应转移电子数为6 KCl中只含有35Cl KCl中同时含有35Cl和37Cl
氧化性由强到弱的顺序为KBrO3 > KClO3 > Cl2 > Br2 ①中KCl 是氧化产物,KBr 发生还原反应 ③中1mol氧化剂参加反应得到电子的物质的量为2mol 反应②中氧化剂与还原剂的物质的量之比为1:6
上述三个反应都有单质生成,所以都是置换反应 氧化性由强到弱顺序为 KBrO3>KClO3>Cl2>Br2 反应②中还原剂与氧化剂的物质的量之比为6:1 ③中lmol还原剂反应则氧化剂得到电子的物质的量为2mol
上述三个反应都有单质生成,所以都是置换反应 氧化性由强到弱的顺序是:KBrO3>KClO3>Cl2>Br2 反应(2)中还原剂与氧化剂的物质的量之比为6;1 (3中1mol氧化剂参加反应得电子的物质的量为2 mol
该反应中电子转移数为6 KCl中只含35Cl KCl中既有35Cl,又有37Cl 生成的氯气式量约为73.3
上述三个反应都有单质生成,所以都是置换反应 氧化性由强到弱顺序为Cl2>Br2 >KBrO3>KClO3 反应②中还原剂与氧化剂的物质的量之比为5:1 反应③中1 mol KBrO3参加反应时有10 mol电子转移
上述三个反应都有单质生成,所以都是置换反应 氧化性由强到弱顺序为 KBrO3>KClO3>Cl2>Br2 反应②中还原剂与氧化剂的物质的量之比为6:1 ③中lmol还原剂反应则氧化剂得到电子的物质的量为2mol
上述三个反应都有单质生成,所以都是置换反应 ③中当有lmol还原剂反应时,则氧化剂得到电子的物质的量为2mol 反应②中还原剂与氧化剂的物质的量之比为6:1 氧化性由强到弱顺序为 KBrO3>KClO3>Cl2>Br2
ClO3->BrO3->IO3->Cl2 BrO3->Cl2>ClO3->IO3- BrO3->ClO3->Cl2>IO3- Cl2>BrO3->ClO3->IO3-