你可能感兴趣的试题
HClO是弱酸,所以NaClO是弱电解质 Cl2具有很强的氧化性,在化学反应中只能作氧化剂 1.12L. Cl2含有1.7NA个质子(NA 表示阿伏加德罗常数) 过量的铁粉与氯气反应生成FeCl3
指示剂应当用大量,目的是能清楚看到颜色改变 多数是有颜色的物质 它们的离解常数决定发生颜色改变时的pH 它们是弱酸和弱碱 温度是影响滴定的一种因素
HClO是弱酸 HClO较稳定,受热不分解 HClO是强氧化性酸 HClO能杀菌消毒
电离平衡常数越小,表示弱电解质的电离能力越弱 电离平衡常数与温度无关 不同浓度的同一弱电解质,其电离平衡常数不同 多元弱酸各步电离平衡常数相互关系为:K1〈K2〈K3
不同浓度的同一弱电解质,其电离平衡常数(K.)不同 电离平衡常数(K.)越小,表示弱电解质电离能力越弱 多元弱酸各步电离平衡常数相互关系为:K.1<K.2<K.3 CH3COOH溶液中加入少量CH3COONa溶液,电离常数减小
NaHCO3溶液中,一定有c(Na+)=c(HCO3-)+c(CO32-) 1 mol·L-1HCN溶液与1mol·L-1 NaOH溶液等体积混合后,测得所得溶液显酸性 等物质的量浓度的各溶液pH关系为:pH(Na2CO3)>pH(NaCN)>pH(CH3COONa) 1mol/L.醋酸溶液加水稀释,所有离子浓度均减小
①②进行的场所完全相同 ③过程增加氨基酸的种类,不增加数目 a种类的数量小于b种类的数量 ③步骤加强不会增加肾脏的负担
电离常数越小,表示弱电解质的电离能力越弱 电离常数与温度无关 不同浓度的同一弱电解质,其电离常数不同 多元弱酸各步电离常数相互关系K1<K2<K3
该一元酸溶液浓度为0.10 mol·L-1 a、b、c点的水溶液导电性依次增强 室温时,HA的电离常数Ka≈l×10-5 a点和c点所示溶液中H2O的电离程度相同
电离常数越小,pH值越低 电离常数越小,pH值越高 不论弱酸的电离常数多大,pH值一定
电离平衡常数(K.)与温度无关 H2CO3的电离常数表达式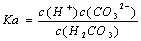 同温下,电离平衡常数越小表示弱电解质电离能力越弱 多元弱酸各步电离平衡常数相互关系为:K123
同温下,电离平衡常数越小表示弱电解质电离能力越弱 多元弱酸各步电离平衡常数相互关系为:K123
各平衡常数的大小与温度有关 若温度升高则各平衡常数一定增大 平衡常数的大小能说明反应(或电离、溶解)进行的程度 平衡常数越大反应(或电离、溶解)程度越大
各溶液pH关系为:pH(Na2CO3)>pH(NaCN)>pH(CH3COONa) a mol·L-1HCN溶液与b mol·L-1NaOH溶液等体积混合,所得溶液中c(Na+)>c(CN-),则a一定小于b 冰醋酸中逐滴加水,则溶液的导电性和pH均先增大后减小 NaHCO3和Na2CO3混合溶液中,一定有2c(Na+)=3〔c(H2CO3)+c(HCO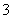 )+c(CO
)+c(CO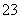 )〕
)〕
各溶液pH关系为:pH(Na2CO3)>pH(NaCN)>pH(CH3COONa) a mol·L-1HCN溶液与b mol·L-1NaOH溶液等体积混合,所得溶液中c(Na+)>c(CN-),则a一定小于b 冰醋酸中逐滴加水,则溶液的导电性和pH均先增大后减小 NaHCO3和Na2CO3混合溶液中,一定有2c(Na+)=3〔c(H2CO3)+c(HCO )+c(CO
)+c(CO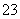 )〕
)〕
胶体的丁达尔效应与微粒直径大小有关 氨气的水溶液能够导电,因此NH3是电解质 电解质溶液的导电能力与溶液中离子浓度及离子所带电荷多少有关 能电离出H+的化合物不一定是酸
碳酸的酸性强于氢硫酸 多元弱酸的酸性主要由第一步电离决定 多元弱酸的各步电离之间无影响 向弱酸溶液中加少量NaOH固体,电离常数不变
电离常数(K.)越小,表示弱电解质电离能力越弱 电离常数(K.)与温度无关 不同浓度的同一弱电解质,其电离常数(K.)不同 多元弱酸各步电离常数相互关系为K.123
等物质的量浓度的各溶液pH关系为pH(NaCN)>pH(Na2CO3)>pH(CH3COONa) amol·L—1HCN溶液与amol·L—1NaOH溶液等体积混合后,所得溶液显碱性(pH>7),则c (OH-)>c(H+),c(Na+)>c(CN-) 冰醋酸中逐滴加水,溶液的导电性、醋酸的电离程度、pH均先增大后减小 NaHCO3和Na2CO3混合溶液中,一定有c(Na+)+c(H+)=c(OH-)+c(HCO3-) +c(CO )
)
HNO2的电离平衡常数:c点>b点 b点混合溶液显酸性:c(Na+)>c(NO2-)>c(H+)>c(OH-) c点混合溶液中:c(OH-)>c(HNO2) d点混合溶液中:c(Na+)>c(OH-)>c(NO2-)>c(H+)
该一元酸溶液浓度为0.10 mol·L-1 a、b、c点的水溶液导电性依次增强 室温时,HA的电离常数Ka≈l×10-5 a点和c点所示溶液中H2O的电离程度相同

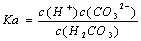 同温下,电离平衡常数越小表示弱电解质电离能力越弱 多元弱酸各步电离平衡常数相互关系为:K1
同温下,电离平衡常数越小表示弱电解质电离能力越弱 多元弱酸各步电离平衡常数相互关系为:K1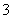 )+c(CO
)+c(CO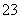 )〕
)〕
 )+c(CO
)+c(CO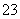 )〕
)〕
 )
)