你可能感兴趣的试题
在甲中滴加丁可能发生反应: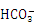 + Ba2++OH-
+ Ba2++OH- BaCO3↓+ H2O 溶液丙中还可以大量共存的离子有:I-、
BaCO3↓+ H2O 溶液丙中还可以大量共存的离子有:I-、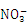 、
、 白色沉淀A.可能溶解在溶液 中 D.甲为NaHCO3,乙为 AlCl3
白色沉淀A.可能溶解在溶液 中 D.甲为NaHCO3,乙为 AlCl3
Al3+ Al(OH)3 AlO2- Al3+和Al(OH)3
Al3+ Al(OH)3 AlO2- Al3+和Al(OH)3
Al3+ Al(OH)3 AlO2﹣ Al3+和Al(OH)3
原溶液中含有的Fe3+和Al3+的物质的量之比为1:1 ab段发生的离子反应为:Al3++3OH-= Al(OH)3↓,Mg2++2OH-= Mg(OH)2↓ 原溶液中含有的阳离子是H+、NH4+、Mg2+、Al3+、Na+ d点溶液中含有的溶质只有Na2SO4
若Y.是盐酸,则Oa段转化为沉淀的离子(表中,下同)只有AlO2﹣ 若Y.是盐酸,则溶液中可能含有的阳离子是Al3+ 若Y.是NaOH溶液,则bc段反应的离子方程式为 Al(OH)3+OH﹣═AlO2﹣+2H2O 若Y.是NaOH溶液,则X.溶液中只存在四种离子是:Al3+、Fe3+、NH4+、Cl﹣
NaOH溶液可以用氨水来代替 溶液a只含有Al3+、K.+、Cl-、Na+、OH- 溶液b中只含有NaCl 向溶液a中滴加盐酸需控制溶液的pH
与AlCl3溶液反应发生的离子方程式为 Al3++3OH—=Al(OH)3↓ 用HNO3溶液完全中和后,溶液不显中性 加水稀释后,溶液中c(NH4+)·c(OH—)变大 1L0.1mol·L-1的氨水中有6.02×1022个NH4+
3mol·L-1氨水的浓度不够大,溶液的碱性不够强 NaF溶液碱性较强,Al3+完全反应生成AlO2-,而AlO2-不能与氨水反应生成Al(OH)3 氨水为弱碱溶液,Al3+不与弱碱反应 Al3+与F.-结合生成新物质,溶液中几乎没有Al3+
原溶液中一定含有的阴离子是:OH—、SiO32—、AlO2—、CO32— 反应最后形成的溶液中的溶质为NaCl 原溶液中一定含有Na2SO4 原溶液中含有CO32- 与AlO2- 的物质的量之比为1∶2

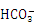 + Ba2++OH-
+ Ba2++OH- BaCO3↓+ H2O 溶液丙中还可以大量共存的离子有:I-、
BaCO3↓+ H2O 溶液丙中还可以大量共存的离子有:I-、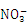 、
、 白色沉淀A.可能溶解在溶液 中 D.甲为NaHCO3,乙为 AlCl3
白色沉淀A.可能溶解在溶液 中 D.甲为NaHCO3,乙为 AlCl3