你可能感兴趣的试题
常温下,0.1 mol·L.-1氨水的电离常数K.约为1×10-5mol·L.-1 a、b之间的点一定满足:c(NH )>c(Cl-)>c(OH-)>c(H+) c点溶液中c(NH
)>c(Cl-)>c(OH-)>c(H+) c点溶液中c(NH )=c(Cl-) d点代表两溶液恰好完全反应
)=c(Cl-) d点代表两溶液恰好完全反应
0.1 mol•L-1NaHCO3溶液: K+、Fe3+、Cl-、NO3- 使甲基橙变红色的溶液:NH4+、Cu2+、ClO-、Na+ 常温下由水电离出的c(H+)=1×10-13mol·L-1的溶液中:Mg2+、Na+、SO32-、NO3- 常温下在c(H+)=1×10-13mol·L-1的溶液中: Na+、K+、SO42-、CO32-
M点溶液中水的电离程度比原溶液大 在M.点时,n(OH-)-n(H+)=(a -0.05)mol 随着NaOH的加入,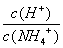 不断增大 当n(NaOH)=0.05mol时溶液中有: c(Cl-)>c(Na+)>c(NH4+)>c(OH-)>c(H+)
不断增大 当n(NaOH)=0.05mol时溶液中有: c(Cl-)>c(Na+)>c(NH4+)>c(OH-)>c(H+)
M.点溶液中水的电离程度比原溶液小 在M.点时,n(OH-)-n(H+)=(a-0.05)mol 随着NaOH的加入,
在M.点时,n(OH-)-n(H+)=(a-0.05)mol 随着NaOH的加入,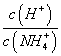 不断减小 当n(NaOH)=0.1mol时, c(OH-)>c(Cl-)>c(NH3·H2O)
不断减小 当n(NaOH)=0.1mol时, c(OH-)>c(Cl-)>c(NH3·H2O)
某醋酸溶液的pH=a,将此溶液稀释1倍后,溶液的pH=b,则a﹥b 在滴有酚酞的氨水里,加入NH4Cl至溶液恰好无色,则此时溶液的pH<7 常温下,1.0×10-3 mol·L-1盐酸的pH=3.0,1.0×10-8 mol·L-1盐酸的pH=8.0 常温下,若1 mL pH=1的盐酸与100 mLNaOH溶液混合后,溶液的pH=7,则NaOH溶液的pH=11
常温下pH=7的溶液中:Fe3+、Mg2+、SO 、Cl-能大量共存 已知电离平衡常数:H2CO3>HClO>HCO3-,向NaClO溶液中通入少量二氧化碳: ClO-+CO2+ H2O =HClO+HCO3- 一定温度下,1L0.5mol·L-1NH4Cl溶液与2L0.25mol·L-1NH4Cl溶液含NH4+物质的量相同 常温下水电离出c(H+)×c(OH-)=10-20的溶液中:Na+、ClO-、SO42 -、NH
、Cl-能大量共存 已知电离平衡常数:H2CO3>HClO>HCO3-,向NaClO溶液中通入少量二氧化碳: ClO-+CO2+ H2O =HClO+HCO3- 一定温度下,1L0.5mol·L-1NH4Cl溶液与2L0.25mol·L-1NH4Cl溶液含NH4+物质的量相同 常温下水电离出c(H+)×c(OH-)=10-20的溶液中:Na+、ClO-、SO42 -、NH 可能大量共存
可能大量共存
常温下将0.1 mol·L-1 NH4Cl溶液与0.05 mol·L-1 NaOH溶液等体积混合, c (Cl-)> c (Na+)> c(NH4+)> c (OH-)> c (H+) 常温下物质的量浓度相等的①NH4HSO4②CH3COONH4③NH4Cl三种溶液中c(NH4+):①>③>② 0.1mol·L-1的NaHA溶液,其pH=11,则溶液中:c(HA-)>c(OH-)>c(A2-)>c(H2A.) 在相同条件下,将足量AgCl加入等体积的①0.01 mol·L-1 KCl②0.1 mol·L-1 KCl溶液③蒸馏水三种液体中,所能溶解的AgCl质量关系为:①>②>③
NH4+离子浓度由大到小的顺序为② > ④ > ① > ③ NH3·H2O分子浓度由大到小的顺序为② > ③ > ① > ④ 溶液的pH由大到小的顺序为③ > ② > ① > ④ 溶液中的离子总浓度由大到小的顺序为④ > ① > ② > ③
盐酸的物质的量浓度为1mol/L 在①、②之间的任意一点:c(Cl﹣)>c(NH4+),c(H+)>c(OH﹣) 在点②溶液中:c(NH4+)=c(Cl﹣)>c(OH﹣)=c(H+),且V.<20 在点③所示溶液中:由水电离出的c(OH﹣)>10﹣7mol/L
常温下,0.l mol/L氨水的电离常数K.约为l×l0-5 mol.L-1 a、b之间的点一定满足:c(NH4+)>c(Cl-)>c(OH-)> c(H+) c点溶液中c(NH4+)=c(Cl-) d点代表两溶液恰好完全反应
M.点溶液中水的电离程度比原溶液小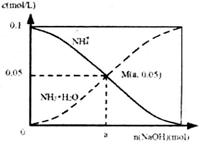 在M.点时,n(OH-)-n(H+)=(a-0.05)mol 随着NaOH的加入,
在M.点时,n(OH-)-n(H+)=(a-0.05)mol 随着NaOH的加入, 不断减小 当n(NaOH)=0.1mol时, c(OH-)>c(Cl-)>c(NH3·H2O)
不断减小 当n(NaOH)=0.1mol时, c(OH-)>c(Cl-)>c(NH3·H2O)
75mL 2mol·L.—1NH4Cl溶液 150mL 3mol·L.—1的KCl溶液 75mL 2mol·L.—1的FeCl3溶液 150mL 1mol·L.—1的NaCl溶液
常温下将0.1 mol·L.-1NH4Cl溶液与0.05 mol·L.-1NaOH溶液等体积混合,c(Cl-) > c(Na+) > c(NH4+) > c (OH-) > c (H+) 常温下,物质的量浓度相等的①NH4HSO4②CH3COONH4③NH4Cl三种溶液中c(NH4+):①>③>② 0.1mol·L.-1的NaHA溶液,其pH=11,则溶液中:c(HA-)>c(OH-)>c(A2-)>c(H2A.) 在相同条件下,将足量AgCl加入等体积的①0.01 mol•L-1AgNO3溶液②0.1 mol•L-1KCl溶液③蒸馏水三种液体中,所能溶解的AgCl质量关系为:①>②>③
常温下0.4 mol/L HB溶液和0. 2 mol/L NaOH溶液等体积混合后溶液的pH=3,则混合溶液中离子浓度的大小顺序为: c(B—)>c(H+)>c(Na+)>c(OH—) 同浓度同体积的NaClO溶液和CH3COONa溶液,离子总数前者小于后者 在1mol/L CH3COOH溶液中加入少量冰醋酸,醋酸的电离平衡正向移动且电离程度增大 常温下0.1 mol/L的下列溶液①NH4Al(SO4)2;②NH4Cl;③NH3·H2O;④CH3COONH4中,c(NH4+)由大到小的顺序是:②>①>④>③
在M.点时,n(OH-)-n(H+)=(a-0.05) mol 随着NaOH的加入, 不断增大 M.点溶液中水的电离程度比原溶液小 当n(NaOH)=0.1 mol时,c(OH-)>c(Cl-)-c(NH3·H2O)
不断增大 M.点溶液中水的电离程度比原溶液小 当n(NaOH)=0.1 mol时,c(OH-)>c(Cl-)-c(NH3·H2O)
常温下醋酸分子不可能存在于pH>7的碱性溶液中 常温下pH=2的H2SO4与pH=13的NaOH溶液混和,所得混和液的pH=11,则H2SO4溶液与NaOH溶液的体积比是9:1 0.1mol/L硫化钠溶液中,c(S2-)+c(HS-)+2c(H2S)=0.1mol/L 常温下向氯化铵溶液中加入少量氨水使溶液的pH=7,则混合溶液中c(NH4+)>c(Cl-)
pH相同的盐酸与氯化铵溶液中,水的电离程度相同 加入少量Mg(OH)2固体,c(NH4+)减小 溶液加水稀释时, 逐渐增大 加入等体积0. 05 mol • L-1的NaOH溶液时: c(Na+) =c(Cl-) >c(NH4+)>c(OH-)>c( H+)
逐渐增大 加入等体积0. 05 mol • L-1的NaOH溶液时: c(Na+) =c(Cl-) >c(NH4+)>c(OH-)>c( H+)

 )>c(Cl-)>c(OH-)>c(H+) c点溶液中c(NH
)>c(Cl-)>c(OH-)>c(H+) c点溶液中c(NH )=c(Cl-) d点代表两溶液恰好完全反应
)=c(Cl-) d点代表两溶液恰好完全反应
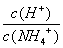 不断增大 当n(NaOH)=0.05mol时溶液中有: c(Cl-)>c(Na+)>c(NH4+)>c(OH-)>c(H+)
不断增大 当n(NaOH)=0.05mol时溶液中有: c(Cl-)>c(Na+)>c(NH4+)>c(OH-)>c(H+)
 在M.点时,n(OH-)-n(H+)=(a-0.05)mol 随着NaOH的加入,
在M.点时,n(OH-)-n(H+)=(a-0.05)mol 随着NaOH的加入,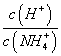 不断减小 当n(NaOH)=0.1mol时, c(OH-)>c(Cl-)>c(NH3·H2O)
不断减小 当n(NaOH)=0.1mol时, c(OH-)>c(Cl-)>c(NH3·H2O)
 、Cl-能大量共存 已知电离平衡常数:H2CO3>HClO>HCO3-,向NaClO溶液中通入少量二氧化碳: ClO-+CO2+ H2O =HClO+HCO3- 一定温度下,1L0.5mol·L-1NH4Cl溶液与2L0.25mol·L-1NH4Cl溶液含NH4+物质的量相同 常温下水电离出c(H+)×c(OH-)=10-20的溶液中:Na+、ClO-、SO42 -、NH
、Cl-能大量共存 已知电离平衡常数:H2CO3>HClO>HCO3-,向NaClO溶液中通入少量二氧化碳: ClO-+CO2+ H2O =HClO+HCO3- 一定温度下,1L0.5mol·L-1NH4Cl溶液与2L0.25mol·L-1NH4Cl溶液含NH4+物质的量相同 常温下水电离出c(H+)×c(OH-)=10-20的溶液中:Na+、ClO-、SO42 -、NH 可能大量共存
可能大量共存
 在M.点时,n(OH-)-n(H+)=(a-0.05)mol 随着NaOH的加入,
在M.点时,n(OH-)-n(H+)=(a-0.05)mol 随着NaOH的加入, 不断减小 当n(NaOH)=0.1mol时, c(OH-)>c(Cl-)>c(NH3·H2O)
不断减小 当n(NaOH)=0.1mol时, c(OH-)>c(Cl-)>c(NH3·H2O)
 不断增大 M.点溶液中水的电离程度比原溶液小 当n(NaOH)=0.1 mol时,c(OH-)>c(Cl-)-c(NH3·H2O)
不断增大 M.点溶液中水的电离程度比原溶液小 当n(NaOH)=0.1 mol时,c(OH-)>c(Cl-)-c(NH3·H2O)
 逐渐增大 加入等体积0. 05 mol • L-1的NaOH溶液时: c(Na+) =c(Cl-) >c(NH4+)>c(OH-)>c( H+)
逐渐增大 加入等体积0. 05 mol • L-1的NaOH溶液时: c(Na+) =c(Cl-) >c(NH4+)>c(OH-)>c( H+)