你可能感兴趣的试题
Na2SO4=2Na++S04-2 Ba(OH)2=Ba2++OH-2 Al2(SO4)3=2A13++3SO42- Ca(N03)2=Ca2++2(N03) 2-
反应中Al2(SO4)3被氧化 Al2(SO4)3、A.12O3均含有离子键和共价键 5.1 gA.12O3含有9.03×1022个阴离子 该反应中,每转移0.3 mol电子生成5.04L. SO2
12O3,对于该反应,下列说法正确的是 A.Fe是氧化剂 Fe2O3被还原 A.1 发生了还原反应 Fe2O3失去电子
FeSO4酸性溶液暴露在空气中:4Fe2++O2+4H+=4Fe3++2H2O 物质的量相等的溴化亚铁跟氯气反应2Fe2++2Br﹣+2Cl2=2Fe3++Br2+4Cl﹣ 向明矾溶液中滴加Ba(OH)2,恰好使SO42﹣沉淀完全: 2A13++3SO42﹣+3Ba2++6OH﹣═2A1(OH)3↓+3BaSO4↓ 向碳酸钠溶液中滴加过量的稀硫酸:CO32﹣+2H+=CO2↑+H2O
物质的量相等的溴化亚铁跟氯气反应:2Fe2++ 2Br-+ 2Cl2=2Fe3++Br2+4Cl- Ca(HCO3)2溶液中加入足量NaOH:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O 向明矾溶液中滴加Ba(OH)2,恰好使SO42-沉淀完全:2A13++3SO42-+3Ba2++6OH-===2A1(OH)3 ↓+3BaSO4↓ 向碳酸钠溶液中滴加过量的稀硫酸: CO32-+2H+=CO2↑+H2O
S+O2 点燃SO2 CuO十CO 高温 Cu+CO2 Fe2O3+2A1 高温 Al2O3+2Fe 3Fe+2O2点燃Fe3O4
CuCl2== Cu2+ +2Cl- Ba(OH)2== Ba2++(OH)2- Al2(SO4)3== 2A13++3SO42- HNO3== H++NO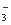
Al2(SO4)3=2A13++3SO42- Ba(OH)2=Ba2++(OH-)2 Na2SO4=2Na++S04-2 Ca(N03)2=Ca2++2(N03) 2-
NH3(g)+HCl(g)=NH4Cl(s) CaCO3(s)=CaO(s)+CO2(g) 4Al(s)+3O2(g)=2A12O.3(s) HCl(aq)+NaOH(aq)=NaCl(aq)+H2O.(1)
足量的硫酸铝溶液与纯碱溶液反应: 2A13++3CO32-+3H2O =2A1(OH)3↓+3CO2↑ NaHS溶液的水解方程式: HS-+H2O H3O++S2- Fe(OH)3与足量的HI溶液反应: Fe(OH)3+3H+=Fe3++3H2O 向亚硫酸氢铵溶液中加入足量的NaOH溶液: NH4++OH-=NH3·H2O
H3O++S2- Fe(OH)3与足量的HI溶液反应: Fe(OH)3+3H+=Fe3++3H2O 向亚硫酸氢铵溶液中加入足量的NaOH溶液: NH4++OH-=NH3·H2O
A1C13 溶液与烧碱溶液反应,当n(OH-) :n(A13+)=7 : 2 时, 2A13++7OH-==A1(OH)3↓+ AlO2-+2H2O 当向饱和Na2CO3溶液中通入过量CO2时,CO32-+CO2 + H2O==2HCO3- CuCl2 溶液与 NaHS 溶液反应,当n(CuCl2):n(NaHS) = l : 2 时, Cu2++2HS-==CuS↓十H2S↑ Fe 与稀硝酸反应,当 n(Fe) : n(HNO3)=l : 2 时,3Fe+2NO3-+8H+==3Fe2+ +2NO↑+4H2O
Na2SO4=2Na++S04-2 Ba(OH)2=Ba2++OH-2 Al2(SO4)3=2A13++3SO42- Ca(N03)2=Ca2++2(N03) 2-
Fe2O3+6HCl=2FeCl3+3H2O Fe2O3十3CO 高温 2Fe+3CO2 Fe2O3+2A1 高温 Al2O3+2Fe Fe2O3+3H2SO4=Fe2 (SO4)3+3H2O
1、Cu片插入浓HNO3中组成原电池(图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示。反应过程中有红棕色气体产生。下列说法错误的是
A.t1时刻前,A.1片的电极反应为:2A1—6e-+3H2O===A12O3+6H+  t1时,因A.1在浓硝酸中钝化,氧化膜阻碍了A.1继续反应 t1之后,负极Cu失电子,电流方向发生改变 烧杯中发生的离子反应为: 2NO2+2OH-=2NO3-+H2O
t1时,因A.1在浓硝酸中钝化,氧化膜阻碍了A.1继续反应 t1之后,负极Cu失电子,电流方向发生改变 烧杯中发生的离子反应为: 2NO2+2OH-=2NO3-+H2O
钠和冷水反应:Na+2H2O==Na++2OH-+H2↑ 金属铝溶于氢氧化钠溶液:Al+2OH-==AlO2-+H2↑ 金属铝溶于盐酸中:2Al+6H+==2A13++3H2↑ 铁跟稀硫酸反应:2Fe+6H+==2Fe3++3H2↑
反应Ⅰ中S.单质是氧化剂 反应Ⅱ中铝元素被氧化 当生成5.4gAl时,反应Ⅰ和Ⅱ共转移1.2mole- 反应Ⅰ中氧化产物与还原产物物质的量之比为2:9
△L2=△L1,ε2=ε1 △L2=2△L1,ε2=ε1 △L2=2△L1,ε2=2ε1 

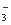
 H3O++S2- Fe(OH)3与足量的HI溶液反应: Fe(OH)3+3H+=Fe3++3H2O 向亚硫酸氢铵溶液中加入足量的NaOH溶液: NH4++OH-=NH3·H2O
H3O++S2- Fe(OH)3与足量的HI溶液反应: Fe(OH)3+3H+=Fe3++3H2O 向亚硫酸氢铵溶液中加入足量的NaOH溶液: NH4++OH-=NH3·H2O
 t1时,因A.1在浓硝酸中钝化,氧化膜阻碍了A.1继续反应 t1之后,负极Cu失电子,电流方向发生改变 烧杯中发生的离子反应为: 2NO2+2OH-=2NO3-+H2O
t1时,因A.1在浓硝酸中钝化,氧化膜阻碍了A.1继续反应 t1之后,负极Cu失电子,电流方向发生改变 烧杯中发生的离子反应为: 2NO2+2OH-=2NO3-+H2O
