你可能感兴趣的试题
CH4-O2燃料电池 C2H5OH-O2燃料电池 H2-O2燃料电池 CO-O2燃料电池
放电过程中,Na+从右向左迁移 a为正极,其电极反应为:BH4--8e-+8OH-=BO2-+6H2O b电极的电极反应式为:H2O2+2e-+2H+=2H2O 每消耗300g、34%的H2O2溶液,理论上流过电路中的电子数为6N.A个
O2—CH4燃料电池 O2—C2H5OH燃料电池 O2—H2燃料电池 O2—CO燃料电池
O2—CH4燃料电池 O2—C2H5OH燃料电池 O2—H2燃料电池 O2—CO燃料电池
该电池可以在高温下正常工作 电池工作时,H+向负极移动 电池工作时,正极周围溶液的PH将不断减少 该电池的总反应式为Mg+H2O2+H2SO4=MgSO4+2H2O
CH4—O2燃料电池 C2H5OH—O2燃料电池 H2—O2燃料电池 CO—O2燃料电池
镁燃料电池中镁均为负极,发生氧化反应 镁次氯酸盐燃料电池的总反应式为: Mg+ClO﹣+H2O═Mg(OH)2+Cl﹣ 镁过氧化氢燃料电池,酸性电解质中正极反应式为: H.2O.2+2H++2e﹣═2H2O. 镁次氯酸盐燃料放电过程中OH﹣移向正极
a电极是负极
b电极的电极反应为:4OH--4e-═2H2O+O2↑
电池工作时H+移向正极
氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置
电极a采用MnO2,MnO2既作电极材料又有催化作用 放电时,每转移2mol电子,理论上需要消耗9.5gNaBH4 电池放电时Na+从b极区移向a极区 电池的负极反应为BH4-+2H2O-8e-=BO2-+8H+
a极是负极,该电极上发生氧化反应 b极反应是O2+4OH--4e-===2H2O 总反应方程式为2H2+O2===2H2O 氢氧燃料电池是一种具有应用前景的绿色电源
电极 是燃料电池的负极
B.电池的电极A.反应为:BH4-+8OH--8e-===BO2-+6H2O
放电过程中,Na+从正极区向负极区迁移
在电池反应中每消耗1L. 6 mol/L H2O2溶液,理论上流过电路中的电子为6N.A个
b为电池的负极 负极的反应式为:4H++O2+4e-→2H2O 氢离子在电解质溶液中向b极移动 总的化学反应可表示为:2H2+O2 2H2O
2H2O
镁燃料电池中镁均为负极,发生氧化反应 镁次氯酸盐燃料电池的总反应式为: Mg+ClO﹣+H2O═Mg(OH)2+Cl﹣ 镁过氧化氢燃料电池,酸性电解质中正极反应式为: H.2O.2+2H++2e﹣═2H2O. 镁次氯酸盐燃料放电过程中OH﹣移向正极
燃料电池工作时,正极反应:O2+2H2O+4e-===4OH- a极是铁,b极是铜时,b极逐渐溶解,a极上有铜析出 a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出 a、b两极均是石墨时,在相同条件下a极产生的气体与电池中消耗的H2体积相等
b电极的电极反应为:4OH--4e-=2H2O+O2↑ a电极是负极 氢氧燃料电池是一种具有应用前景的绿色电源 氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置
电池放电时Na+从a极区移向b极区 燃料电池是一类能量转化效率高、环境友好的发电装置 该电池的负极反应为BH4-+ 8OH-一8e-═BO2-+ 6H2O 在电池反应中,每消耗3molH2O2,转移电子数为3NA
电极 是燃料电池的负极
B.电池的电极A.反应为:BH4-+8OH--8e-===BO2-+6H2O
放电过程中,Na+从正极区向负极区迁移
在电池反应中,每消耗1L. 6 mol/L H2O2溶液,理论上流过电路中的电子为6N.A个
a极是负极,该电极上发生氧化反应 b极反应是O2+4OH--4e-===2H2O 总反应方程式为2H2+O2===2H2O 氢氧燃料电池是一种具有应用前景的绿色电源
当a、b都是铜做电极时,电解的总反应方程式为: 2CuSO4+2H2O 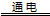 2H2SO4+2Cu+O2↑ 燃料电池工作时,正极反应为:O2+2H2O+4e-
2H2SO4+2Cu+O2↑ 燃料电池工作时,正极反应为:O2+2H2O+4e- 4 OH— 当燃料电池消耗2.24L 甲醛气体时,电路中理论上转移2mol e- 燃料电池工作时,负极反应为:HCHO+ H2O —2e-
4 OH— 当燃料电池消耗2.24L 甲醛气体时,电路中理论上转移2mol e- 燃料电池工作时,负极反应为:HCHO+ H2O —2e- HCOOH + 2H+
HCOOH + 2H+

 2H2O
2H2O
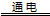 2H2SO4+2Cu+O2↑ 燃料电池工作时,正极反应为:O2+2H2O+4e-
2H2SO4+2Cu+O2↑ 燃料电池工作时,正极反应为:O2+2H2O+4e- 4 OH— 当燃料电池消耗2.24L 甲醛气体时,电路中理论上转移2mol e- 燃料电池工作时,负极反应为:HCHO+ H2O —2e-
4 OH— 当燃料电池消耗2.24L 甲醛气体时,电路中理论上转移2mol e- 燃料电池工作时,负极反应为:HCHO+ H2O —2e- HCOOH + 2H+
HCOOH + 2H+